NEWSお知らせ
ジスルフィド結合導入酵素によるたんぱく質の立体構造形成促進機構を解明 ~構造異常たんぱく質が引き起こす神経変性疾患などの原因解明に光~
発表のポイント
● 高速原子間力顕微鏡を用いた観察により、ジスルフィド結合導入酵素プロテインジスルフィドイソメラーゼ(PDI)が、構造未成熟な基質を捕獲する様子を可視化することに世界で初めて成功した。
● 高速原子間力顕微鏡により捉えたPDIの動きが、たんぱく質の効率的な立体構造形成促進に重要であることを明らかにした。
● PDIの基質認識機構および立体構造形成促進機構に対する理解が深まったことにより、構造異常たんぱく質が引き起こす種々の疾病の成因解明につながると期待される。
概要
東北大学 学際科学フロンティア研究所の奥村正樹助教、東北大学 多元物質科学研究所の稲葉謙次教授(生命科学研究科、大学院理学研究科化学専攻 兼任)、熊本大学 発生医学研究所の小椋光教授、野井健太郎博士(現 大阪大学 ナノサイエンスデザイン教育研究センター 特任助教)らの研究グループは、JST戦略的創造研究推進事業において、高速原子間力顕微鏡注1)により、ジスルフィド結合注2)導入酵素プロテインジスルフィドイソメラーゼ(PDI)が構造未成熟な基質を捕獲する様子を可視化することに世界で初めて成功し、同酵素によるたんぱく質の立体構造形成促進機構に関する全く新しい概念を提唱しました。
細胞内には、たんぱく質高次構造の形成反応を促進する仕組みがあります。特に構造未成熟なたんぱく質の構造修復の仕組みは、我々の生体内で不良たんぱく質の蓄積を防ぐために必要不可欠です。しかしながら、いまだどのようにして細胞内の補助因子が構造未成熟なたんぱく質を認識し、構造修復のため働いているのかよくわかっていませんでした。
PDIファミリーたんぱく質注3)の1つであるPDIは、哺乳動物細胞の小胞体注4)内で、立体構造形成前のたんぱく質にジスルフィド結合を導入させたり誤って形成されたジスルフィド結合を修復したりなどの機能を担っています。PDIの結晶構造注5)は4つのドメインから構成されるU字構造であり、動きに富むことが示唆されていましたが、この動きがPDIの機能発現にどう関わるか解明されていませんでした。
そこで、高速原子間力顕微鏡による1分子レベルでの観察により、PDIが酸化還元状態依存的にドメインの動きを制御していることを明らかにしました。さらに、BPTI、RNaseA、ラミニン、プラスミノーゲンといった形や大きさ、ジスルフィド結合の数が異なるさまざまな基質を還元変性させた状態で添加すると、PDIは二量体へ会合し、その中央に形成される空間(キャビティ)に基質が取り込まれる様子を観察することに世界で初めて成功しました。これにより、PDIが触媒するたんぱく質の酸化的フォールディング注6)の全く新しいモデルを提唱するに至りました。
本研究成果は、2019年4月15日16時(英国時間)に「Nature Chemical Biology」のオンライン速報版で公開されます。
発表内容
宇宙には通常の物質の約5倍の総量のダークマターがあることが分かっています。例えば、通常の物質しか存在しない場合、我々が住む天の川銀河に属する星はバラバラに宇宙空間に飛び散ってしまいます。しかし実際には、銀河を取り囲むようにダークマターが存在し、その巨大な重力により、星々はバラバラにならず銀河に留められています。また、現在の標準的なシナリオでは、ダークマターが多く存在するところに星が形成され、またその星々が集まって銀河が形成されてきたと考えられています。しかし、そのような重要な役割を持ちながらダークマターの正体は分かっていません。ダークマターの最有力候補の一つは未発見の素粒子ですが、地下素粒子実験や欧州原子核研究機構 (CERN) の LHCなどの加速器実験でも、その手かがりは得られていません。
ダークマターのもう一つの候補が、宇宙が高温かつ高密度だった宇宙初期に形成されたかもしれないブラックホール(以後、原始ブラックホール)です。原始ブラックホールの可能性については、ホーキング博士が1970年代に最初に提案しました。例えば月質量(太陽の質量の約2700万分の1)より軽い原始ブラックホールがダークマターである可能性は、従来の観測では否定されていませんでした。
そこで、東京大学国際高等研究所カブリ数物連携宇宙研究機構 (Kavli IPMU) の高田昌広主任研究者、大学院生の新倉広子さん、安田直樹教授を中心とする研究チームは、原始ブラックホールがダークマターである可能性を調べるため、ハワイすばる望遠鏡に搭載された超広視野主焦点カメラ Hyper Suprime-Cam (HSC; ハイパー・シュプリーム・カム) で観測されたアンドロメダ銀河の画像を解析しました。アンドロメダ銀河は、我々の最も近傍(距離約260万光年)にある、我々の天の川銀河のような巨大渦巻き銀河です。このため、地球とアンドロメダ銀河のあいだの宇宙空間には、大量のダークマターがあるはずです(図1参照)。つまり、原始ブラックホールがダークマターであれば、沢山のブラックホールが存在することになるはずです。本研究チームは、光を出さないブラックホールの存在を検証するために、重力レンズ効果に着目しました。この重力レンズは次のような観測現象です。原始ブラックホールがアンドロメダ銀河の星の手前を横切ったとき(原始ブラックホールとアンドロメダ銀河の星が視線方向にほぼ一直線上に並んだとき)、その星に対して原始ブラックホールは重力レンズ効果を引き起こします(図2参照)。つまり、空の上で原始ブラックホールがアンドロメダ銀河の星に近づくときには、その星は明るく見え、ブラックホールが遠ざかるときには暗くなるという、星の明るさが特徴的な時間変化を示すことになります。月質量程度の原始ブラックホールの場合は、天球上のアンドロメダ銀河の星とブラックホールの位置関係、あるいはブラックホールの速度に従って、星の明るさの時間変化は典型的に10分から数時間にかけて起こります。これは、変光星など明るさが変化する通常の星と比較して、短い時間変動です。この重力レンズ効果では、星の多重像を分解して観測できず、一つの星が明るさだけ変化するように見える現象なので、重力マイクロレンズ効果とも呼ばれます。
しかし、重力レンズ効果は非常に稀な現象で、滅多に起こりません。それでも、アンドロメダ銀河の多数の星を観測し、また地球とアンドロメダ銀河の間の広大な空間には大量のダークマター、つまり多数の原始ブラックホールが存在すれば、重力マイクロレンズが起こる確率は非常に高いはずです。この重力マイクロレンズ効果の探索には、HSCの広視野とすばる望遠鏡の口径 8.2mの集光力が威力を発揮しました。HS の広視野はアンドロメダ銀河全体(星が分布する領域)を一度に見渡すことができます(図2の上図を参照)。また、すばる望遠鏡の高い集光力により、90秒の短い露出時間でもアンドロメダ銀河の個々の星からのわずかな光を捕らえ、約9000万個の星を同時測定できました。
本研究チームは、この重力マイクロレンズの現象を見つけるために、2014年の11月23日の快晴の夜に、約7時間にわたり約2分間隔で約190枚のアンドロメダ銀河の連続画像をHSCで取得しました。その画像を詳しく解析し、明るさが変化している星を探したところ、約15,000個もの時間変動する星を発見することができました。さらに、その時間変動する星から、重力マイクロレンズ効果が予言する明るさの時間変動と一致する天体、つまり重力レンズ効果の候補天体を探しました。その結果、ダークマターが原始ブラックホールである場合は1,000個程度の重力レンズ効果を発見できるという予言に対して、たった1個だけの重力マイクロレンズ候補星を見つけました(図3参照)。これが本当の原始ブラックホールの重力マイクロレンズ効果であれば大発見となることから、追観測が待たれます。逆に、たった1個の重力レンズ候補天体しかなかったということは、これが本当の原始ブラックホールであったとしても、原始ブラックホールの総量はダークマターの約0.1% 程度の質量にしか寄与していないことになります。
そして本研究により、ダークマターが原始ブラックホールである可能性を検証しました (図4参照)。具体的には、太陽質量の10億分の1(月質量の30分の1程度)の軽い原始ブラックホールがダークマターであるシナリオを初めて棄却しました。一方、今回の観測では、太陽質量の1-10兆分の1程度の原始ブラックホールがダークマターである可能性は棄却できませんでした。今回の成果は天文学だけでなく、素粒子物理学にも影響を与える成果です。
今後、本国際共同研究チームは、アンドロメダ銀河をHSCでさらに観測し、時間変動天体、原始ブラックホールの重力マイクロレンズ効果の探索研究を発展させる予定です。例えば、米国のレーザー干渉計重力波天文台LIGO で観測されたブラックホールが原始ブラックホールかどうか調べようとしており、更なる成果が期待されます。
本成果は、以下の事業・研究領域・研究課題によって得られました。
科学技術振興機構(JST) 戦略的創造研究推進事業 チーム型研究(CREST)
研究領域:「ライフサイエンスの革新を目指した構造生命科学と先端的基盤技術」
(研究総括:田中 啓二 東京都医学総合研究所 理事長)
1)研究課題名:「小胞体恒常性維持機構:Redox, Ca2+, タンパク質品質管理のクロストーク」
研究代表者:永田 和宏(京都産業大学 総合生命科学部 教授)
研究期間:平成25年10月~平成31年3月
2)研究課題名:「ATP/GTP が駆動するタンパク質マシナリーの動的構造生命科学」
研究代表者:安藤 敏夫(金沢大学 理工研究域バイオAFM先端研究センター 特任教授)
研究期間:平成25年10月~平成31年3月
科学技術振興機構(JST) 科学技術人材育成のコンソーシアムの構築事業
「連携型博士研究人材総合育成システム(次世代研究者育成プログラム)」
支援対象者:奥村 正樹(東北大学 学際科学フロンティア研究所 助教)
支援期間:平成29年5月~平成31年3月
文部科学省 新学術領域研究
研究領域:「新生鎖の生物学」
(研究総括:田口 英樹 東京工業大学 科学技術創成研究院 教授)
研究課題名:「新生鎖の立体構造形成を支えるジスルフィド形成システムの解明」
研究代表者:稲葉 謙次 (東北大学 多元物質科学研究所 教授)
研究期間:平成26年7月~平成31年3月
文部科学省 新学術領域研究
研究領域:「動的構造生命」
(研究総括:神田 大輔 九州大学 生体防御医学研究所 教授)
研究課題名:「分子認識による酸化的フォールディングの1分子観察」
研究代表者:奥村 正樹 (東北大学 学際科学フロンティア研究所 助教)
研究期間:平成27年4月~平成29年3月
熊本大学発生医学研究所の「発生医学の共同研究拠点」
研究課題名:「翻訳途中の新生鎖に働きかけるPDI familyの直接観察」
研究代表者:奥村 正樹 (東北大学 学際科学フロンティア研究所 助教)
研究期間:平成29年4月~平成30年3月
文部科学省ナノテクノロジープラットホーム
研究課題名:「X線小角散乱法によるPDIファミリー酵素とそのパートナー酵素との複合体の構造解析」
研究代表者:奥村 正樹 (東北大学 学際科学フロンティア研究所 助教)
研究期間:平成28年4月~平成29年3月
公益財団法人 上原記念生命科学財団、公益財団法人 内藤記念科学振興財団、公益財団法人 武田科学振興財団、研究代表者:奥村 正樹 (東北大学 学際科学フロンティア研究所 助教)、および公益財団法人 武田科学振興財団 研究代表者:稲葉 謙次 (東北大学 多元物質科学研究所 教授)の研究の一環として行われました。
研究の背景
小胞体は分泌たんぱく質や膜たんぱく質が合成される細胞内小器官であり、そこにはジスルフィド結合形成を促進する酵素やたんぱく質の凝集を抑制する分子シャペロン注7)などが存在します。ジスルフィド結合の形成、組み換えは高次構造を獲得するために必須であり、ジスルフィド結合形成が不可欠なたんぱく質には生物学的、医学的にも重要なインスリン、免疫グロブリン、血液凝固因子などが知られています。
一方で、ジスルフィド結合は誤ったシステイン間で形成されることもあります。そのような結合はたんぱく質の構造異常を誘起するため、小胞体内にはジスルフィド結合の修復システムが備えられています。不良たんぱく質の蓄積は神経変性疾患注8)や糖尿病などを引き起こすと考えられるため、構造未成熟な不良たんぱく質の構造修復の仕組みは、我々の生体内において極めて重要な役割を担っています。
そのため、哺乳動物細胞の小胞体中にはジスルフィド結合の形成を触媒する酵素として20種類以上ものPDIファミリーたんぱく質が存在し、たんぱく質の品質管理を行っています。特にPDIは、PDIファミリーたんぱく質の中でも最も研究が進んでおり、誤って形成されたジスルフィド結合を修復し、正しい酸化的フォールディングを促進する能力に長けています。しかし、大きさやジスルフィド結合の数が多様なたんぱく質に対して、PDIがどのように認識し、はたらきかけるのか、その作用機序はこれまで不明でした。
研究の内容と成果
当研究グループでは、高速原子間力顕微鏡(高速AFM)という手法により、PDIが酸化還元状態依存的に4つのドメインで構成されるU字構造の開閉を制御し、この構造制御がさまざまな基質の効率的な酸化的フォールディングの触媒に重要な役割をもつことを明らかにしました。さらに、BPTI、RNaseA、 ラミニン、プラスミノーゲンといった形や大きさ、ジスルフィド結合の数が異なるさまざまな基質を還元変性させた状態で添加すると、PDIが二量体化することを発見しました(図1、図2)。立体構造形成前の基質はPDI二量体の中央に形成される空洞に取り込まれ、そこで迅速なジスルフィド結合の導入と構造形成を受けることを明らかにしました。
この現象は、大きさやジスルフィド結合の数が異なる複数種類の基質に対しても同様に観察されることがわかりました。また、変性状態にある基質依存的に形成されたPDI二量体は基質のフォールディング状態(どの程度、立体構造形成が進んでいるか)や構造形成し易さ(フォールディング速度)に応じて寿命や形状を変えることを突き止めました。このように、二量体を形成することで生じる中央の空洞中に変性基質を捕獲し、効率的な酸化的フォールディングを促すというPDIの全く新しい触媒機構を提唱しました(図3)。
今後の展開
パーキンソン病やアルツハイマー病など種々の神経変性疾患は体内で構造異常たんぱく質が過剰に蓄積することで引き起こされることが知られています。これまでにPDIの変異や機能欠損を引き起こす化学修飾が、さまざまな神経変性疾患の患者から見つかっています。今回新たにPDIの動的性質や二量体形成が、サイズやジスルフィド結合の数が異なるさまざまなたんぱく質のジスルフィド結合を効率的に導入する上で重要な役割を果たすことを明らかにしました。
以上の基礎的知見は、生体内における高効率・高精度なたんぱく質の構造形成促進の触媒機構の新たな解明につながり、神経変性疾患や2型糖尿病などのフォールディング病に関する有用な情報を提供するものと期待されます。
参考図
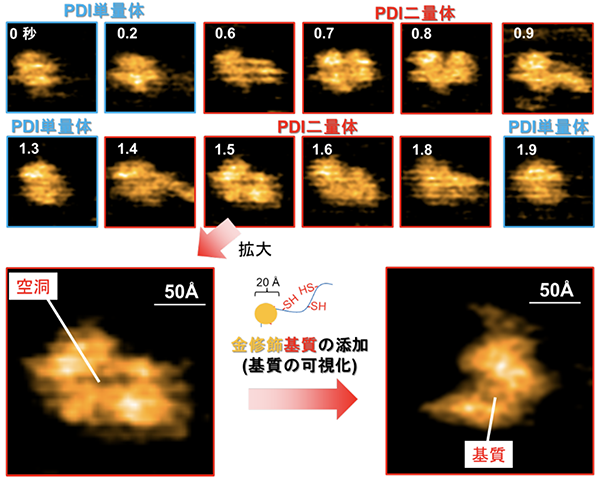
図1:PDIの二量体形成
(上図)構造未成熟な基質を添加するとPDIは二量体を形成し、基質の立体構造形成に応じて単量体へと解離する。PDI二量体を拡大すると空洞が生じていることがわかる。
(下図)この空間に基質が取り込まれる様子。この中央の空洞が、基質の酸化的フォールディングの触媒に重要な役割を果たす。
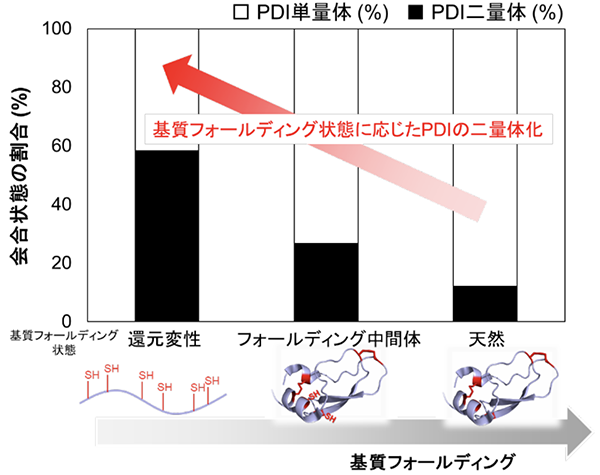
図2:基質のフォールディング状態に応じたPDIの二量体形成
還元変性した基質を添加するとPDIは約60%まで二量体を形成するが、基質のフォールディング反応が進行するとPDIは単量体となる。二量体化したPDIが還元変性した基質に迅速にジスルフィド結合を導入することも、本研究により示された。
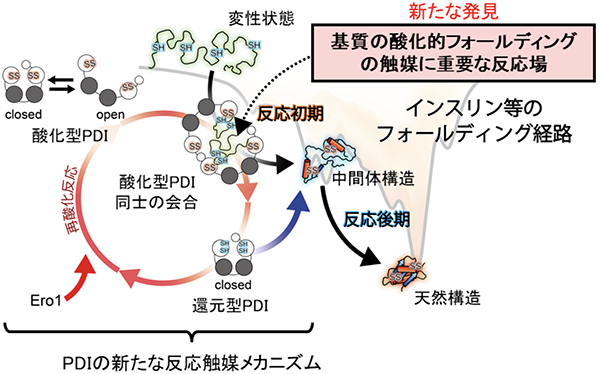
図3:PDIの新たな酸化的フォールディング触媒メカニズム
PDIが促進する酸化的フォールディング機構では、まず酸化型PDIが構造の開閉を利用して変性状態の基質を効率よく捕獲する。これに伴い、PDIは二量体を形成し、その中央に形成される空洞内で基質の酸化的フォールディングが効率的に進行する。基質のフォールディング状態や速度に応じてPDI二量体が寿命や形状を変えることで、さまざまな基質に対し、立体構造形成の促進および修復を行うことが示された。PDIが基質にジスルフィド結合を導入すると、自身の活性部位は還元状態になる。還元型のPDIはEro1と呼ばれる酸化酵素によって速やかに再酸化される。PDIとEro1は酵母からヒトまで高度に保存されている。
用語解説
注1)高速原子間力顕微鏡(高速AFM)
基板に固定した分子を、先が極めて細い針で触れながら高速に走査することで、分子の形状と動きを一分子レベルでリアルタイムに観測するナノテクノロジー。
注2)ジスルフィド結合
近接する2つのシステイン残基のチオール官能基(-SH)が酸化され、硫黄原子間で架橋される共有結合。たんぱく質の立体構造形成を安定化する役割がある。
注3)PDIファミリーたんぱく質
ジスルフィド結合の形成、組み換え、開裂を担う小胞体中に存在する酵素群のこと。ヒト細胞の小胞体中では20種類以上のPDIファミリーたんぱく質が存在する。
注4)小胞体
細胞内小器官の1つであり、分泌たんぱく質が合成される。この区画で、分泌たんぱく質は酵素依存的に糖鎖修飾やジスルフィド結合形成を受ける。
注5)結晶構造
X線結晶構造解析と呼ばれる手法によって決定される分子構造。多くの場合は高分解能であり、原子レベルで分子構造を決定することができる。
注6)酸化的フォールディング
ジスルフィド結合形成と共役して、たんぱく質の立体構造が形成される反応のこと。インスリンや免疫グロブリンなど医学的にも重要な多くのたんぱく質も、このプロセスを経て、立体構造および生理機能を獲得する。
注7)分子シャペロン
たんぱく質の立体構造形成を助ける分子の総称。多くは、たんぱく質の凝集を抑制する役割を有する。「シャペロン」とはフランス語で若い女性が社交界デビューする際の介添人を意味する。
注8)神経変性疾患
中枢神経を構成する特定の細胞群が死ぬために発症する脳神経疾患の1つ。構造異常たんぱく質の蓄積や沈着が神経細胞群の死を引き起こす主要因の1つと考えられている。
発表雑誌
タイトル:Dynamic assembly of protein disulfide isomerase in catalysis of oxidative folding
(酸化的フォールディング触媒におけるPDIの動的会合機構の解明)
著者名:Masaki Okumura, Kentaro Noi, Shingo Kanemura, Misaki Kinoshita, Tomohide Saio, Yu-ichi Inoue, Takaaki Hikima, Shuji Akiyama, Teru Ogura, and Kenji Inaba
掲載誌:Nature Chemical Biology, UK
DOI:10.1038/s41589-019-0268-8
問い合わせ先
稲葉 謙次(イナバ ケンジ)
東北大学 多元物質科学研究所 教授
〒980-8577 宮城県仙台市青葉区片平2丁目1-1
Tel:022-217-5604
E-mail:kinaba[at]tagen.tohoku.ac.jp
Posted on:2019年4月16日





