【プレスリリース】細胞膜上のアミノ酸トランスポーターを分解する新たな機構を解明~細胞内のアミノ酸量を制御する新たな仕組み~
国立大学法人東北大学は、細胞外からのアミノ酸の取り込みに関わるアミノ酸トランスポーターの新たな品質管理(分解)機構*1 とその生理学的意義の一端を初めて解明しました。これは、東北大学大学院生命科学研究科の松井貴英博士大学院生と福田光則教授による研究成果です。
わたしたちの体を構成する細胞は、蛋白質の部品となるアミノ酸を全て自前で合成している訳ではなく、細胞外からも取り入れています。このアミノ酸の取り込みの役割を担う細胞膜上の蛋白質が「アミノ酸トランスポーター」です。細胞が正しく生存・増殖するためには、細胞膜上のアミノ酸トランスポーターの発現量を維持することが重要と考えられますが、細胞膜と細胞内をリサイクルされるアミノ酸トランスポーターの品質管理の仕組みはこれまで全く解明されていませんでした。
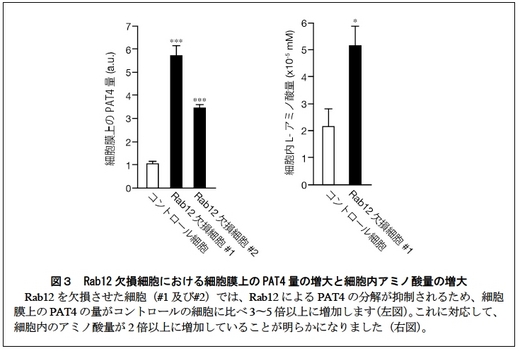
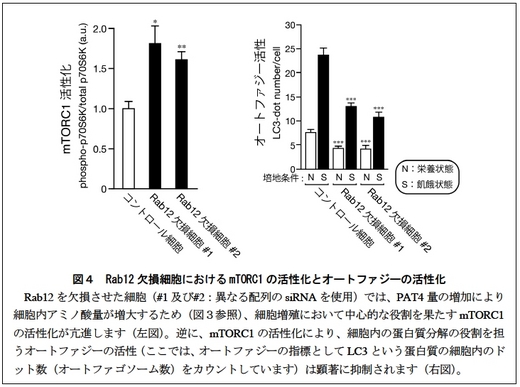
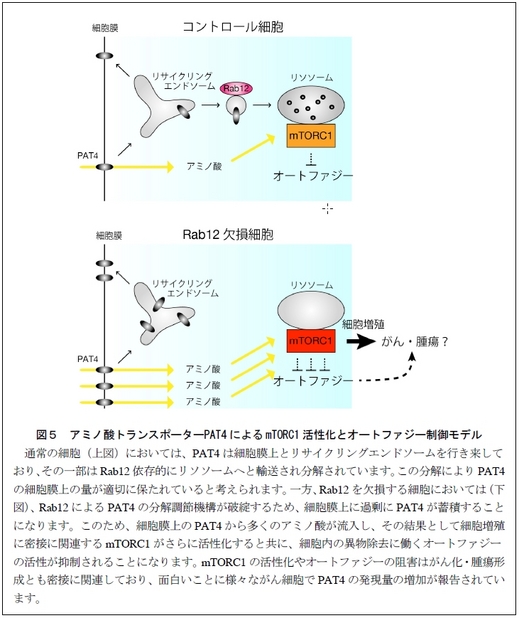
今回、研究グループはマウスの胚性線維芽細胞(MEF 細胞)を用いて、細胞膜上のアミノ酸トランスポーターの一種PAT4(パット4)がリサイクリングエンドソームを経由してリソソーム*2 で分解されるという新規の品質管理機構を明らかにしました。すなわち、PAT4は細胞膜と細胞内のリサイクリングエンドソームを行き来するだけでなく、その一部は低分子量G 蛋白質Rab12*3 の作用によりリソソームへと輸送され分解を受けることを突き止めました。このためRab12 を欠損するMEF 細胞では、細胞膜上のPAT4 量が増大し、結果的に細胞内アミノ酸量が増大することが明らかになりました。
細胞内アミノ酸量の増大は細胞増殖とも密接な関連があり、PAT4 はがん細胞で発現が上昇していることから、今後、がん治療という観点からRab12 によるPAT4 分解の研究が進展することが期待されます。
本研究成果は、欧州分子生物学機構機関誌『EMBO Reports』電子版(2013年3月12日)に掲載される予定です。
【論文題目】
Matsui, T. & Fukuda, M. (2013) Rab12 regulates mTORC1 activity and autophagy through controlling the degradation of amino acid transporter PAT4. EMBO Rep., in press.
「低分子量G 蛋白質Rab12 はアミノ酸トランスポーターPAT4 の分解を制御することによりmTORC1 の活性とオートファジーを制御する」
 松井さんと福田先生(3月8日の記者レクチャーにて)
松井さんと福田先生(3月8日の記者レクチャーにて)
(お問い合わせ先)
東北大学大学院生命科学研究科
教授 福田光則(ふくだ みつのり)
Tel:022-795-7731(or 022-795-3641)
E-mail: nori*m.tohoku.ac.jp(*を@に置き換えてください)
■プレスリリース(PDF)
■記者レクチャー資料(PDF)
■東北大学へのリンク
■東北大学生命科学研究科 膜輸送機構解析分野のホームページはこちら
【背景】
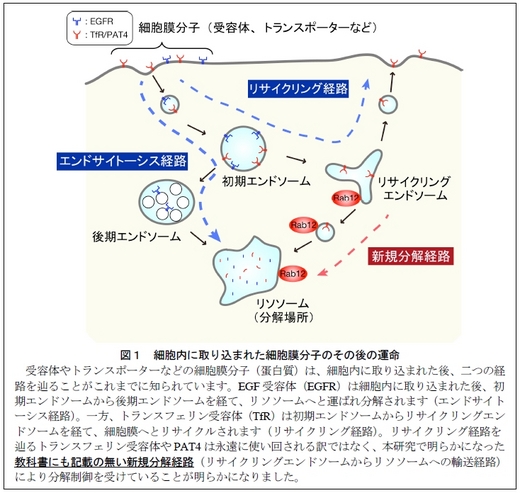
わたしたちの体を構成する細胞は細胞膜により外界から隔てられており、外界からの刺激や栄養物質を受け取るため、細胞膜上に多数の受容体やトランスポーターなどの蛋白質分子を配置しています。これらの分子は常に細胞膜に存在している訳ではなく、必要に応じて細胞内に取り込まれ、その後不要になった分子はリソソームと呼ばれるオルガネラ(細胞内小器官)で分解される、あるいは、一部のリサイクル可能な分子は、リサイクリングエンドソーム*2 と呼ばれるオルガネラを経由して細胞膜へと再びリサイクルされます。例えば、増殖刺激を受け取った上皮成長因子受容体(EGF 受容体)は細胞内に取り込まれた後、図1に示すような経路(エンドサイトーシス経路)でリソソーム*2 まで運ばれ分解されます。一方、鉄の取り込みに関与するトランスフェリン受容体は細胞内に取り込まれた後、リサイクリングエンドソームへと分別され、再び細胞膜へとリサイクルされます(リサイクリング経路)。トランスフェリン受容体のようにリサイクルされる分子に関しても、永遠に同じ分子を使い続けるとは考えがたく、何らかの品質管理機構*1 が存在するものと想定されますが、リサイクルされる受容体の分解の仕組みはこれまでほとんど解明されていませんでした。
2011 年に研究グループはトランスフェリン受容体が常にリサイクルされるのではなく、一部は低分子量G 蛋白質Rab12*3 依存的に恒常的に分解されることを見出していましたが、この分解(経路)の生理学的意義はこれまで明らかではありませんでした。今回わたしたちは、細胞膜上でアミノ酸の取り込みを行う蛋白質・アミノ酸トランスポーターに着目し、PAT4(パット4:proton-coupled amino acid transporter 4)と呼ばれるトランスポーター分子の品質管理(分解)機構の解明に挑みました。
【研究成果】
本研究ではまず、細胞内の物質輸送に本研究ではまず、細胞内の物質輸送に関与する制御蛋白質(交通整理人)の一種Rab(ラブ)に着目し、マウスに存在する全てのRab 分子を網羅的に解析するシステムを構築しました。具体的には、RNA 干渉法*4 を用いてマウスに存在する58 種類のRab をそれぞれ特異的にノックダウンするツール(siRNA)を作製しました。次にこれらのsiRNA を一つずつマウス胚性線維芽細胞(MEF 細胞)に導入し、細胞内アミノ酸量の変化に敏感に応答することが知られているmTORC1 の活性*5 やオートファジー(自食)活性*6 への影響を検討しました。その結果、以下のことを明らかにすることができました。
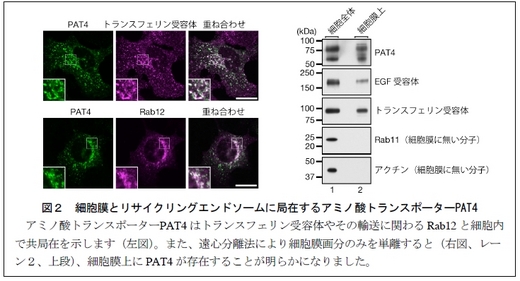
1. トランスフェリン受容体と同じく、細胞膜上とリサイクリングエンドソームを行き来するアミノ酸トランスポーターとしてPAT4 を同定しました。PAT4 はMEF 細胞においてトランスフェリン受容体と共局在を示し(図2左上)、細胞膜上にも存在しています(図2右)。
2. マウスに存在する全てのRab 分子を対象とした網羅的なノックダウン解析から、PAT4 の分解を制御するRab として、リサイクリングエンドソームからリソソームへの新規の輸送経路(図1の赤矢印)に関わるRab12 を同定しました。Rab12 は輸送するPAT4 や目的地となるリソソームとも共局在を示します(図2左下)。Rab12 を欠損するMEF 細胞においては、細胞膜上のPAT4 の量が顕著に増大し(図3左)、細胞内のアミノ酸量が有意に増大することが明らかになりました(図4右)。
3. Rab12 欠損MEF 細胞においては、アミノ酸量が増大するため、細胞増殖において中心的な役割を果たすmTORC1 の活性が上昇し(図4左)、結果的にオートファジー活性が顕著に減少することが明らかになりました(図4右)。
以上の結果から、Rab12 は細胞膜とリサイクリングエンドソームを行き来するアミノ酸トランスポーターPAT4 の一部を、リサイクリングエンドソームからリソソームへと輸送し、分解する役割を担っています(図5上の模式図)。Rab12 のノックダウンや機能不全により、PAT4の分解が抑制されると、細胞膜上にはPAT4 が蓄積することになります(図5下の模式図)。細胞膜上に蓄積したPAT4 からは細胞内にアミノ酸が流入し、増加したアミノ酸がmTORC1の過剰な活性化を引き起こし、結果的に細胞内の異物除去に重要な役割を果たすオートファジーの誘導が阻害されます。
【今後の展開】
mTORC1 は細胞増殖において中心的な役割を果たすため、がん抑制のターゲットとしても注目されています。また、mTORC1 の活性化により阻害されるオートファジーに関しても、オートファジー活性の阻害によりがん・腫瘍が誘発されることが知られています。さらに、様々ながん細胞でアミノ酸トランスポーターPAT4 の発現量が増大していることが最近報告されており、今後、PAT4 分子やその輸送に関わるRab12 をターゲットとしたがん・腫瘍抑制の創薬への応用も将来的に期待されます。
※本研究成果は、独立行政法人日本学術振興会・科学研究費補助金「リサイクリングエンドソームからリソソームへの新規分解経路の同定とその機能解明」(研究代表者:福田光則 東北大学大学院生命科学研究科教授)によるものです。
【図及び説明】
【用語説明】
*1 蛋白質の品質管理
リボソームで合成された蛋白質は正しい形に折りたたまれて機能を発揮します。小胞体上で正しく折りたたまれなかった蛋白質や機能を果たせなくなった蛋白質など(不良品)は細胞から排除する必要があります。この管理機構のことを品質管理と呼びます。これまで小胞体での品質管理機構は良く解析されていますが、細胞内と細胞膜をリサイクルされる細胞膜蛋白質の品質管理(分解)はこれまでほとんど明らかになっていませんでした。
*2 リサイクリングエンドソームとリソソーム
リサイクリングエンドソームとリソソームはオルガネラと呼ばれる膜で包まれた細胞内小器官の一種で、前者は細胞内に取り込まれた受容体やトランスポーターなどを再び細胞膜へと戻す役割を担い(図1のリサイクリング経路)、後者は逆に分解の役割を担います(図1のエンドサイトーシス経路)。
*3 低分子量G 蛋白質Rab(ラブ)
細胞毎で小胞の輸送を適切に行うためには交通整理人(制御蛋白質)の存在が不可欠です。この交通整理人の一つとして酵母から高等ほ乳動物のヒトまで普遍的に存在しているのが低分子量G 蛋白質Rab です。ヒトやマウスには約60 種類のRab 蛋白質が存在し、様々な小胞の輸送に関与すると考えられていますが、種類数が非常に多いこともあり未だ機能が不明のRab蛋白質が多数存在しています。今回同定したRab12 は、リサイクルされる細胞膜蛋白質(PAT4など)をリソソームへと導き分解を行う役割を担っています(図1の赤矢印)。
Rab12 に関する関連論文:Matsui, T., Itoh, T. & Fukuda, M. (2011) Small GTPase Rab12 regulates constitutive degradation of transferrin receptor. Traffic 12:1432-1443
*4 RNA 干渉法
20 塩基程度の二本鎖RNA(siRNA)を細胞内に発現させると、その配列と相補的なRNA のみが特異的に分解され、その結果、目的の蛋白質の発現を特異的にノックダウンすることができます。
*5 mTORC1(mammalian target of rapamycin complex 1)
mTORC1 はほ乳動物の細胞内シグナル伝達に関与するリン酸化酵素(セリン・スレオニンキナーゼ)の一種で、ラパマイシンという薬剤の標的として知られています。栄養・エネルギー状態、酸化還元状態、成長因子など細胞内外の環境情報を統合し、転写・翻訳などを通じて、細胞増殖、オートファジー(自食)(*6 参照)などの調節に中心的な役割を果たすと考えられています。例えば、細胞内のアミノ酸量の増加によりmTORC1 の活性が亢進することが知られています。
*6 オートファジー(自食)
細胞内の蛋白質分解機構の一種で、全ての真核生物に普遍的に見られる現象です。栄養環境が悪化した際の栄養供給、細胞内に侵入した病原菌や蓄積した異常蛋白質の排除、さらには細胞のがん化抑制など幅広い生命現象に関与することが知られています。上記*5 のmTORC1 の制御を受け、mTORC1 が活性化された状態の時にはオートファジーは抑制されています。