【プレスリリース】細胞の大きさを制御する新たな分子を同定! ~腎臓肥大を伴う嚢胞性腎疾患の新たな治療法への応用期待~
ポイント
▪ 腎臓尿細管は大きさの揃った一層の細胞(上皮細胞)によって成り立つ
▪ 腎臓尿細管の上皮細胞の大きさを制御する新たな分子を同定
▪ この分子の機能を破綻させると細胞の大きさが肥大
▪ 腎臓肥大を伴う嚢胞性腎疾患のモデルマウスでこの分子の発現異常が観察
概要
国立大学法人東北大学は、腎臓尿細管の上皮細胞の大きさを制御する新たな分子を同定しました。これは、東北大学大学院生命科学研究科の安田貴雄博士(日本学術振興会特別研究員)、福田光則教授による研究成果です。
胃や腸の消化管、腎臓尿細管は、単層上皮と呼ばれる大きさの揃った一層の上皮細胞が互いに密着し合うことによって成り立っています。このような上皮細胞は、隣り合った細胞や細胞外マトリックスと接する膜領域(=側底膜)*1 といずれとも接しない膜領域(=頂端膜)*1 を持ち、それぞれが異なる役割を果たしています。例えば、腎臓尿細管の頂端膜にはアクアポーリン2 と呼ばれる水チャネルが特異的に存在し、原尿からの水の再吸収を行っています。二つの膜領域は物理的に隔てられているため、それぞれの膜領域で働くタンパク質は細胞内小胞輸送*2 と呼ばれる仕組みによって、別個に輸送されています。わたしたちの研究室では、これまで頂端膜への小胞輸送を制御する分子として低分子量Gタンパク質の一種Rab27*3とその結合分子「Slp2-a」*4 を同定しています。Slp2-a は比較的分子量の大きなタンパク質で、小胞輸送を行う際に重要なRab27 と結合する部位以外にも、機能未知の部位が存在しており、それらの上皮細胞における役割はこれまで明らかではありませんでした。
今回、研究グループはイヌの腎臓尿細管由来の細胞株を用いて、Slp2-a に上皮細胞の大きさを制御する新たな機能があることを突き止めました。Slp2-a は細胞膜に存在しており、その機能を破綻させると細胞の大きさが肥大することが明らかになりました。また、腎臓肥大を伴う嚢胞性腎疾患*5 のモデルマウスでSlp2-a の発現異常が観察されたことから、今後Slp2-a の下流のシグナルをターゲットにした嚢胞性腎疾患の新たな治療法への応用が期待されます。
本研究成果は、英国の科学雑誌『Journal of Cell Science』の電子版に間もなく掲載される予定です。
▪ プレスリリース(PDF)
▪ 東北大学へのリンク
▪ 生命科学研究科 膜輸送機構解析分野 研究室
■ 報道 ■
・日刊工業新聞11月26日付
河北新報12月11日付
東北大学大学院生命科学研究科・膜輸送機構解析分野
教授 福田 光則(ふくだ みつのり)
電話番号:022-795-7731(or 022-795-3641)
Eメール: nori*m.tohoku.ac.jp(*を@に置き換えてください)
背景
腎臓は、血液からの老廃物や余分な水分のろ過及び排出(尿)を行う重要な器官です。腎臓の尿細管は、糸球体から集合管に至るまでの原尿の通り道となる管(チューブ)状の組織で、原尿成分から水分や無機塩類などの再吸収を行ないます(図1上段左側)。腎臓尿細管は、単層上皮と呼ばれる大きさの揃った一層の上皮細胞が互いに密着し合うことによって成り立っています。尿細管の上皮細胞を取り巻く細胞膜は、隣り合った細胞や細胞外マトリックスと接する膜領域(=側底膜)*1 といずれとも接しない膜領域(=頂端膜)*1 の二種類から成り立っており、それぞれが異なる役割を果たしています。二つの膜領域は密着結合と呼ばれる構造物によって物理的に隔てられているため(図1上段右側)、それぞれの膜領域で働くタンパク質は細胞内小胞輸送*2 と呼ばれる仕組みによって、別々に輸送されています。例えば、頂端膜への小胞輸送には、低分子量G タンパク質Rab27*3 とその結合分子「Slp2-a」*4 が重要な役割を果たすことがこれまでの研究で明らかになっています。腎臓が正しく機能を発揮するためには、個々の上皮細胞内での細胞内小胞輸送に加えて、大きさの揃った上皮細胞を正しく配置し、管状の構造を取ることが重要です。これらの機構の破綻は腎臓機能の障害(すなわち、腎疾患 ⇒人工透析の必要性)に直結することから、その仕組みの解明は生物学のみならず医科学において重要な研究課題と考えられますが、その詳細は未だ十分に解明されていません。
研究成果
本研究ではまず、腎臓尿細管上皮細胞の頂端膜への小胞輸送に関与する分子として同定された「Slp2-a」の機能解析の過程で、Slp2-a ノックダウン細胞の大きさが通常よりも肥大することを偶然見出しました(図2)。次に、Slp2-a 分子に存在する機能未知の部位の解析(結合分子の探索ならびに下流のシグナルの同定)を行い(図3)、Slp2-a による腎臓尿細管上皮細胞の大きさ制御の分子機構の解明に取り組みました。さらに、腎臓肥大を伴う嚢胞性腎疾患*5 のモデルマウスpcy*6 に着目し、Slp2-a の機能破綻と疾患発症との関連性を検討することにより(図4)、以下のことを明らかにすることができました。
1.Slp2-a をノックダウンしたイヌの腎臓尿細管由来の細胞株(MDCK II 細胞)は、野生型の細胞に比べ細胞の面積が増大している。細胞の肥大は、単一の細胞培養(未分化の状態)で特に顕著であるが(図2左上段)、上皮細胞様に分化させた状態でも観察される(図2右上段)。
2.Slp2-a ノックダウン細胞に野生型のSlp2-a 分子を戻してやると、細胞の肥大の症状がレスキューされる。興味深いことに、Rab27 との結合能を部位特異的なアミノ酸置換法により欠損させ、小胞輸送を促進できないSlp2-a 変異体(E11A/R32A)をSlp2-a ノックダウン細胞に戻しても、細胞の大きさは回復する(図2下段)。すなわち、Rab27 を介した小胞輸送の機能とは無関係にSlp2-a は細胞の大きさを制御していると考えられる。
3.Slp2-a 分子に存在する機能未知の部位(C2B ドメイン)に細胞の大きさ制御に関わることが知られているRap1GAP2 が結合する(図3左側)。野生型の細胞ではSlp2-a がRap1GAP2を細胞膜上にリクルートするが、Slp2-a ノックダウン細胞ではRap1GAP2 が細胞膜に局在できないため(図3右側)、細胞の大きさ制御に関わるRap という分子の機能を正しく調節できない。
4.Slp2-a → Rap1GAP2 → Rap のシグナル経路の下流では、細胞膜とアクチンを結ぶERM タンパク質の一種ezrin が細胞の大きさ制御に機能する(図4左側)。Slp2-a ノックダウン細胞では、ezrin が通常よりも活性化された状態(リン酸化の亢進)にあり(図4中央)、細胞の肥大を促進するが、ezrin を薬理学的に不活性化(リン酸化の減少)すると細胞の大きさがレスキューされる(図4右側、矢印)。
5.Slp2-a はノックダウンだけでなく、過剰発現によっても細胞の肥大が引き起こされる(過剰量のSlp2-a によりRap1GAP2 の細胞膜への移行が阻害される)(図5)。Slp2-a の発現量は細胞の大きさ制御に重要と考えられる。
6.腎臓肥大の症状を示す嚢胞性腎疾患のモデルマウス(pcy)においては(図6左側)、Slp2-aとその下流因子であるezrin の過剰な活性化が観察される(図6中央)。特に、Slp2-a と活性化ezrin は腎嚢胞に顕著に発現が観察される(図6右側、矢頭)。
以上の結果から、Slp2-a にはRap-ezrin のシグナル経路を調節することにより、腎臓尿細管上皮細胞の大きさを制御する新たな機能があることが明らかになりました。Slp2-a を欠損する細胞(あるいは過剰に発現する細胞)では、Rap1GAP2 が細胞膜上に局在できないため(図3及び図5)、適切なRap 分子の不活性化が起こらず、ezrin が活性化(リン酸化)されるため、細胞が肥大することが明らかになりました(図4)。興味深いことに、腎臓肥大を伴う嚢胞性腎疾患モデルマウスでSlp2-a のタンパク質発現量の亢進が観察され、腎嚢胞部位でのezrin の異常な活性化が起こっていました。
今後の展開
今回の研究により、『Slp2-a が尿細管上皮細胞の大きさを制御する新規分子』であること、そして『嚢胞性腎疾患の病態との関連性』が強く示唆されました。嚢胞性腎疾患による腎臓肥大はやがて腎障害を引き起こし、人工透析が必要となることから、その治療法の開発は重要な課題となっています。しかし、嚢胞性腎疾患の根本的な治療法は未だ確立されていません。嚢胞性腎疾患では恒常的に抗利尿ホルモン・バソプレッシンの分泌量が亢進されており、病態発症の原因の一つと考えられることから、これまでバソプレッシン受容体(V2R)をターゲットとした創薬が行われてきました。しかし、V2R の阻害剤であるトルバプタン(図7)は口の渇き、頻尿などの副作用を示すため、新たな治療薬の開発が期待されています。最近、ニーマン・ピック病 C 型治療薬であるミグルスタット(図7)の類似化合物が、嚢胞性腎疾患のモデルマウスの腎臓肥大を抑える効果があることが報告されましたが、その詳細な仕組みは明らかで はありませんでした。ミグルスタットは細胞膜に存在する脂質の一種・セラミドにグルコースを付加する酵素(グルコシルセラミド合成酵素)の阻害薬として知られており、細胞内セラミド量の増加を引き起こします。セラミドはezrin の脱リン酸化酵素(PP1/2A)を活性化することから、ミグルスタットによりezrin の不活性化(脱リン酸化)が起こると考えられます(図4右側)。すなわち、腎嚢胞で活性化しているezrin 分子(図6右側、矢頭)を阻害することができれば、腎臓肥大を抑えることが可能ではないかと考えられます。ezrin の特異的な機能阻害剤の探索は世界的に見てもまだ始まったばかりですが、今後、ezrin やその上流因子Slp2-a を新規ターゲットとした嚢胞性腎疾患の治療法への応用が期待されます。
図及び説明
(上段左側)腎臓は左右一対ある器官で、「肝腎」という言葉が示すように、血液からの老廃物や余分な水分のろ過及び排出(尿)など、体液の恒常性維持に重要な役割を果たす。(上段中央)腎単位(ネフロン)=腎小体+尿細管。「腎小体」は袋状の組織で、毛細血管の固まりからなる「糸球体」とそれを取り囲む「ボーマン嚢」により形成される。腎小体は左右の腎臓に約100 万個存在し、原尿の生成を行う。原尿は尿細管、集合管を経て、必要な成分(水や無機塩類など)の再吸収が行われた後、尿となって体外へと排出される。(上段右側)尿細管の上皮細胞は、単層上皮とも呼ばれ、一層の大きさの揃った細胞が互いに密着して成り立っている。隣り合った細胞や基底膜と接する領域を「側底膜」、そのいずれとも接しない領域を「頂端膜」と呼び、両者は「密着結合」と呼ばれる構造物によって互いに隔離されている(*1参照)。このため、頂端膜や側底膜で働くタンパク質は極性輸送(*2参照)と呼ばれる特殊な輸送システムによりそれぞれの膜領域に輸送される。
(下段)腎臓尿細管の管(チューブ)状構造の形成のモデル図を示す。研究グループのこれまでの解析で、Rab27-Slp2-a の機能によるシグナル分子・ポドカリキシンの頂端膜への輸送が管状構造の形成には不可欠であることが示されている(詳細は、*4の関連論文Nature Cell Biol. (2012)を参照)。ポドカリキシンの細胞外領域には負電荷を有するシアル酸が多く含まれるため(図中で、-で示す)、互いの電気的反発によって細胞の隙間を形成する。加えて、この領域には水分子やイオンを通す膜タンパク質が集積しており、細胞の隙間に水分子やイオンが流れ込むことで中央に管腔形成が進行すると考えられている。
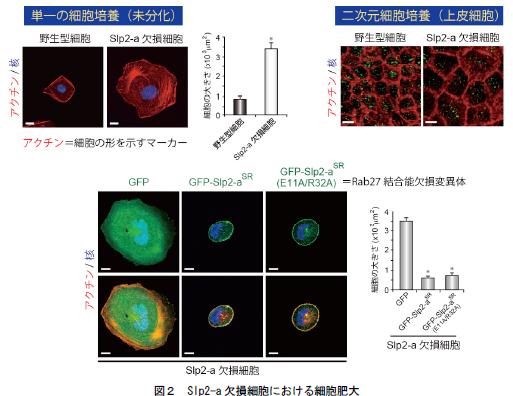
(左上段)単一に培養した野生型細胞及びRNA 干渉法によりSlp2-a をノックダウンしたMDCK II細胞の核(青)及びアクチン(赤:細胞の形を示すマーカー)の染色像を示す。Slp2-a 欠損細胞では細胞の大きさが顕著に増大する。(右上段)二次元培養で上皮細胞様に分化させた野生型細胞及びSlp2-a 欠損細胞を示す。単一培養と同様にSlp2-a の欠損により細胞の肥大が観察される。
(下段)Slp2-a 欠損細胞に緑色蛍光タンパク質(GFP:緑色)を融合したSlp2-a を戻すと、細胞膜に局在し、細胞肥大の症状がレスキューされる(中央の写真)。同様なレスキュー効果は、Rab27 の結合能を欠損させた変異体(E11A/R32A)でも観察された(右の写真)。スケールバー = 10μm。
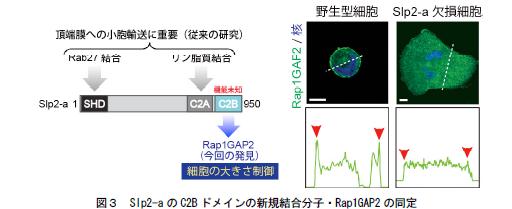
(左側)Slp2-a の分子構造を示す。本研究により、これまで機能未知のC2B ドメインに細胞の大きさ制御に関わるRap1GAP2 が結合することが明らかになった。(右側)野生型細胞及びSlp2-a 欠損細胞におけるRap1GAP2 の細胞内局在を示す。野生型細胞ではRap1GAP2 は細胞膜に局在するが(赤矢頭)、Slp2-a 欠損細胞では細胞質に存在する。スケールバー = 10μm。
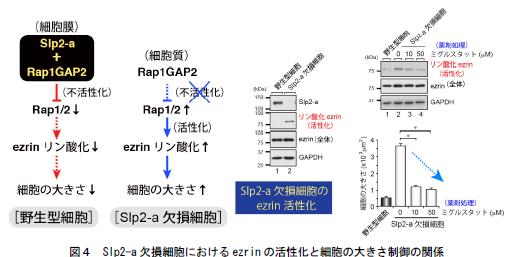
(左側)本研究により明らかになった野生型細胞及びSlp2-a 欠損細胞における細胞の大きさ制御のシグナル経路を示す。野生型細胞においては、Slp2-a がRap1GAP2 を細胞膜にリクルートし、細胞膜上のRap 分子(Rap1 及びRap2)を不活性化する。このためezrin のリン酸化(活性化)は抑制され、細胞の大きさはコンパクトに保たれる。一方、Slp2-a 欠損細胞では、細胞膜上にSlp2-a が無く、Rap1GAP2 は細胞質中に存在するため、Rap 分子が活性化される。このためezrin のリン酸化が促進され、細胞の肥大が起こる。(中央)Slp2-a 欠損細胞におけるezrin のリン酸化の亢進を示す。
(右側)薬剤処理(ミグルスタット:Miglustat)によりezrin のリン酸化を抑制すると、リン酸化の減少に伴い細胞の大きさも減少する(矢印)。
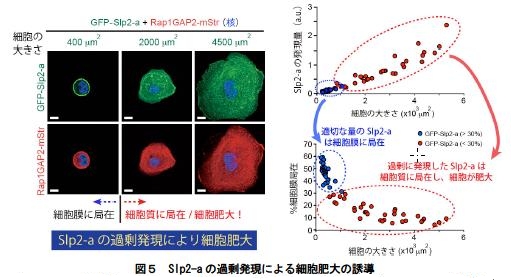
(左側)GFP を融合したSlp2-a と赤色蛍光タンパク質(mStr)を融合したRap1GAP2 を過剰に発現した細胞の大きさを示す。Slp2-a の発現量が適切な場合には、Slp2-a は細胞膜に局在し(左上の写真)、Rap1GAP2 も細胞膜上に存在する(左下の写真)。一方、Slp2-a の発現量が過剰になると、細胞質に局在するようになり、それに伴いRap1GAP2 も主に細胞質に局在するようになる。スケールバー = 10μm。(右側)Slp2-a の細胞内発現量と細胞の大きさ(上段のグラフ)、細胞膜局在(下段のグラフ)の関係を示す。Slp2-a の発現量が適切な時には細胞膜に局在し(青丸)、細胞の大きさに影響は見られないが、Slp2-a の発現が過剰になると(赤丸)細胞質に存在し、細胞が肥大化する。
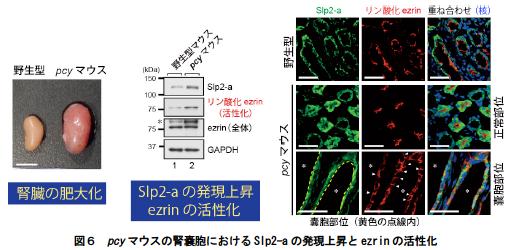
(左側)野生型マウスと嚢胞性腎疾患のモデルマウスpcy の腎臓の大きさの比較を示す。スケールバー = 1 cm。(中央)pcy の腎臓においては、Slp2-a の発現量が増加し、ezrin のリン酸化が亢進する。(右側)野生型マウスとpcy マウスの腎臓近位尿細管におけるSlp2-a と活性化ezrin(リン酸化)の細胞内局在を示す。野生型マウスやpcy マウスの近位尿細管の正常部位では、活性化ezrin は頂端膜に局在するが(右上段、中段の写真)、腎嚢胞(星印の領域)の部位では、活性化ezrin が側底膜で異常な活性化を示す(矢頭)。スケールバー = 50μm。
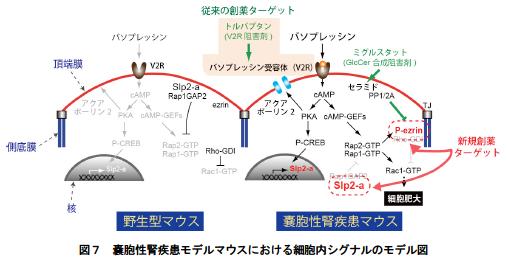
(左側)野生型のマウスでは、原尿からの水の再吸収が必要な際に、抗利尿ホルモン・バソプレッシンが脳下垂体後葉から放出され、腎臓尿細管上皮細胞の頂端膜上に存在するバソプレッシン受容体(V2R)に結合する。V2R は細胞内セカンドメッセンジャーであるcAMP の量を増加させ、水チャネル(アクアポーリン2)の頂端膜への発現を誘導し、水の再吸収を行う。
(右側)嚢胞性腎疾患モデルマウスでは、恒常的にバソプレッシンの分泌量が亢進されているため、cAMP のシグナルが活性化された状態にある。Slp2-a の発現はcAMP のシグナルで増加するため、細胞質中のSlp2-a 分子のタンパク質量が増加し、Rap1GAP2 の細胞膜への移行が阻害されると考えられる。このため、Rap1/2 の活性化、ezrin の活性化(特に側底膜での異所的リン酸化)が細胞肥大を引き起こすと推測される(詳細は*4の関連論文参照)。
嚢胞性腎疾患の治療薬としては、V2R をターゲットにしたトルバプタンが開発されているが、副作用があり、新たな治療薬の開発が期待されている(詳細は本文、今後の展開の項を参照)。
用語説明
*1 上皮細胞の側底膜と頂端膜
全ての細胞は、細胞膜と呼ばれるリン脂質でできた膜で外界から隔てられています。上皮細胞を取り巻く細胞膜は、圴一ではなく、機能的・構造的に二種類の膜領域に区別することができます。隣り合った細胞や細胞外マトリックスでできた基底膜と接する領域(=側底膜)とそのいずれとも接しない領域(=頂端膜)に分けられます(図1上段右側参照)。両者は密着結合と呼ばれる構造物によって互いに隔離されているため、それぞれの膜領域で働くタンパク質や脂質分子は、別個の仕組み(*2参照)で輸送されると考えられています。
*2 細胞内小胞輸送
『2013 年度のノーベル医学・生理学賞』の対象となった細胞の生理現象で、細胞内の物質(例えば、ホルモン、神経伝達物質、メラニン色素など)を小胞などの膜に包み込んで必要とされる場所に適格に輸送する現象です。上皮細胞の場合には、側底膜と頂端膜にそれぞれ別個に小胞が輸送されることから、特に極性輸送と呼ばれています。
*3 低分子量G タンパク質Rab(ラブ)
細胞内で小胞の輸送(膜交通)を適切に行うためには交通整理人(制御タンパク質)の存在が不可欠です。この交通整理人の一つとして酵母から高等ほ乳動物のヒトまで普遍的に存在しているのが低分子量G タンパク質Rab です。ヒトやマウスには約60 種類のRab タンパク質が存在し、様々な小胞の輸送に関与すると考えられています。Rab はGTP というヌクレオチドを結合した活性化型とGDP を結合した不活性化型の二つの状態をとり、活性化型のGTP-Rabがエフェクターと呼ばれる特異的なタンパク質(例えば、Rab27 に関しては下記*4のSlp2-aなど)と結合することにより小胞(Rab27 の場合にはメラニン色素を含む小胞やホルモン顆粒)を輸送します。
*4 Slp2-a(スリップツー)
Rab27 の結合分子として同定され、メラニン色素を含む小胞(メラノソーム)の細胞膜へのつなぎ止めに関与することがこれまでに知られていました(関連プレスリリース参照)。最近研究グループは、Slp2-a 分子がメラノソームの輸送だけでなく、上皮細胞の頂端膜へのシグナル分子(ポドカリキシン)の極性輸送(*1参照)を促進し、管腔(チューブ状の空洞構造)形成を制御することを明らかにしています(詳細は、関連論文参照)。
▪ 『メラニン色素』の輸送メカニズムを解明‐肌や髪の毛が黒くなる仕組み‐
・関連論文
▪ Yasuda, T., Saegusa, C., Kamakura, S., Sumimoto, H. & Fukuda, M. (2012) Rab27 effector Slp2-atransports the apical signaling molecule podocalyxin to the apical surface of MDCK II cells andregulates claudin-2 expression. Mol. Biol. Cell 23, 3229-3239
▪ Gálvez-Santisteban, M., Rodriguez-Fraticelli, A. E., Bryant, D. M., Vergarajauregui, S., Yasuda, T.,Bañón-Rodríguez, I., Bernascone, I., Datta, A., Spivak, N., Young, K., Slim, C. L., Brakeman, P. R.,Fukuda, M., Mostov, K. E. & Martín-Belmonte, F. (2012) Synaptotagmin-like proteins control the formation of a single apical membrane domain in epithelial cells. Nature Cell Biol. 14, 838-849
▪ 安田貴雄・福田光則 (2013) Slp2-a によるシグナル伝達分子podocalyxin のapical 輸送と細胞間相互作用への影響. 生化学, 85:106-110
*5 嚢胞性腎疾患
嚢胞性の腎疾患の総称で、常染色体優性多発性嚢胞腎(Autosomal dominant polycystic kidney disease:ADPKD)など多くの症候群を含んでいます。中でも、常染色体優性多発性嚢胞腎はわが国においても、約1,000 人にひとりという高い発症率を示します。内液を満たした多数の嚢胞形成による「腎臓肥大」を特徴とし、腎機能の低下に伴い多くの患者がやがて腎不全に至り、人工透析を必要とします。しかし、嚢胞性腎疾患の根本的な治療法は未だ確立されておらず、新たな治療薬の開発が期待されています。
*6 嚢胞性腎疾患モデルマウス(pcy)
nephrocystin-3(NPHP3)遺伝子にミスセンス変異を持つ自然発症ミュータントマウスで、ヒト嚢胞性腎疾患のモデルマウスとして良く用いられています。図6に示すように、腎臓の肥大と嚢胞を特徴とします。
論文題目
Yasuda, T. & Fukuda, M. (2013) Slp2-a controls renal epithelial cell size through regulation ofRap-ezrin signaling independently of Rab27. J. Cell Sci., in press
「Slp2-a はRab27 非依存的にRap-ezrin シグナルを制御することにより腎臓上皮細胞の大きさを制御する」