お知らせ

- トップ
- お知らせ
ドミノ転位反応で新規アニリンの効率的な合成法を開発 新薬・新材料開発への応用を期待
発表のポイント
● 4つの連続した炭素上に原子団(注1)をもつアニリン(注2)化合物の効率的・選択的な合成法の開発。
● 銅を触媒として用いたドミノ転位という反応形式により実現。
● 新薬や新材料の開発への応用が期待できる。
概要
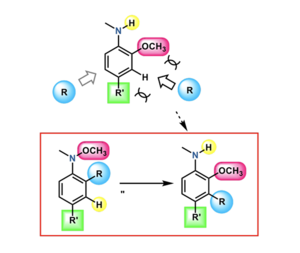 アニリン化合物は、解熱鎮痛薬(アセトアミノフェン)をはじめとした医薬品や液晶や有機ELなどの有機材料として幅広く利用されており、それらの性質をコントロールする原子団を持ったアニリン化合物の効率的な合成法の開発は重要です。東北大学大学院理学研究科化学専攻の石田恭裕博士、中村達准教授、寺田眞浩教授は、市販の化合物から容易に得られる物質を用い、4つの原子団(アミノ基、メトキシ基、アルキル基+任意の原子団)が連続的に配置されたアニリン化合物が効率的に合成される新手法(ドミノ転位反応)を開発しました。従来の方法では、このようなアニリン化合物の合成は、多段階の過程が必要であり、効率性も低いものでした。本成果は、市販の有機化合物から容易に得られる物質に対して銅を触媒として作用させることにより、これまで有機合成においてあまり活用例のない「ドミノ転位反応」という形式で、この多置換アニリン化合物の効率的合成を実現しました。この手法により合成された新規アニリン化合物が新薬や新材料の開発に応用されることが期待できます。
アニリン化合物は、解熱鎮痛薬(アセトアミノフェン)をはじめとした医薬品や液晶や有機ELなどの有機材料として幅広く利用されており、それらの性質をコントロールする原子団を持ったアニリン化合物の効率的な合成法の開発は重要です。東北大学大学院理学研究科化学専攻の石田恭裕博士、中村達准教授、寺田眞浩教授は、市販の化合物から容易に得られる物質を用い、4つの原子団(アミノ基、メトキシ基、アルキル基+任意の原子団)が連続的に配置されたアニリン化合物が効率的に合成される新手法(ドミノ転位反応)を開発しました。従来の方法では、このようなアニリン化合物の合成は、多段階の過程が必要であり、効率性も低いものでした。本成果は、市販の有機化合物から容易に得られる物質に対して銅を触媒として作用させることにより、これまで有機合成においてあまり活用例のない「ドミノ転位反応」という形式で、この多置換アニリン化合物の効率的合成を実現しました。この手法により合成された新規アニリン化合物が新薬や新材料の開発に応用されることが期待できます。
背景
アニリン化合物は医薬品や有機材料などで幅広く利用されている有機化合物です。このため、アニリンに電子的あるいは立体的な性質を調節する置換基を導入する手法の開発は創薬・材料科学の発展において重要です。アニリン化合物の古典的な合成法としては、ベンゼン化合物のニトロ化を経由する手法が広く用いられてきましたが、強酸性条件が必要とされることから、酸に弱い置換基には適用することができません。さらには、オルト位とパラ位のニトロ化が併発すると共に、電子求引基(エステル基やケトン基など)をもつアニリンにおいて反応性が低下するという合成上の問題点も抱えています。この問題を克服する手法として近年、イリジウムやルテニウムなどの遷移金属を触媒として用いることによりアニリンのベンゼン環上の炭素-水素結合に直接置換基を導入する手法が精力的に研究されています。しかしながら、これらの手法は隣接する置換基の立体的影響を受けやすく、他の位置に置換基が入る副反応が起こる場合もあることから、3つ以上の置換基が連続的に配置されたアニリンの効率合成には未だ困難とされています。
研究の経緯
転位反応は分子を構成する原子または原子団が結合位置を変えて構造が変化する反応であり、加熱や光照射、酸、塩基、金属などの添加により促進されます。中村准教授らは、金属錯体を触媒として用いた転位反応の研究を行なっており、その一環として近年窒素上にアルコキシ基を有するアニリン化合物(N-アルコキシアニリン)に対して、カチオン性銅触媒を作用させることにより、アルコキシ基が窒素からオルト位へと[1,3]-転位することを明らかにしました(図1a)。この反応機構の解析により、銅触媒による窒素-酸素結合が切れた後に、陽電荷が非局在化したベンゼン環(A)上での炭素-酸素結合の構築を経由することが示唆されました。
そこで、中村准教授らはオルト位に電子供与性のアルキル基(R1)をもつ基質を用いれば、その電子供与効果により転位反応がアルキル基と結合したオルト位に選択的に進行し、さらに生じた中間体 B' において転位したメトキシ基からの電子供与によりオルト置換基 (R1) が隣のメタ位へと連続的に転位([1,2]-転位)すると考え(図1b)、この窒素上のアルコキシ基とオルト位の置換基が連続して進行するドミノ転位反応により、アミノ基、アルコキシ基、アルキル基が三連続で置換したアニリンの合成法の開発を目指しました。
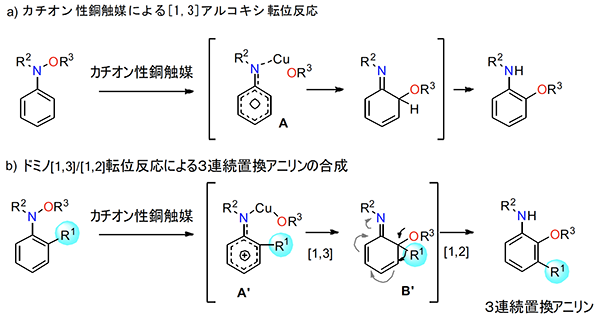
図1:銅触媒によるN-アルコキシアニリンの[1,3]-アルコキシ転位反応
研究成果
窒素上にメトキシ基、オルト位にメチル基などのアルキル基をもつ基質 1 に対して、N-ヘテロサイクリックカルベンが配位した銅錯体から調製したカチオン性銅触媒を作用させることにより、目的とする3連続置換アニリン(3位置換-2-アニシジン) 2 が高収率で得られることを明らかにしました。特にあらかじめパラ位に置換基(R)を持つ基質の反応により4連続置換型のアニリンが効率的に合成できる。さらに電子求引性のメチルエステル基(COOCH3)や反応性が高いブロモ基(Br)などの置換基が反応条件において安定であり、幅広い置換パターンのアニリン誘導体の合成が可能となりました。反応機構の研究により
1) 反応が確かに[1,3]-転位により生じるオルト-キノールイミン中間体 (3)を経由する
2) [1,3]転位と[1,2]転位の両過程ともに銅触媒によって促進されている
ことを明らかにしました。
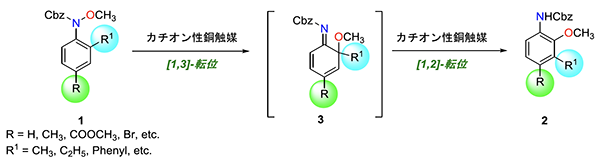
図2:
今後の展開
アニリン化合物は医薬品や有機材料として幅広く利用されていることから、本反応を用いて合成された生成物がそれらの研究に応用されることが期待できます。また、ドミノ型連続変換プロセスに適用できる転位反応のさらなる開発により、更に多様な置換基を有する芳香族化合物が効率的に合成する新しい方法が提供できると考えられます。
用語説明
注1)原子団
分子中において原子が化学結合で連結した部分構造のこと。アミノ基(NH2)、メトキシ基(OCH3)など。また、ベンゼンなどの特定の母核構造に対して結合した原子団のことを置換基という。
注2)アニリン
アミノ基(NH2)がベンゼンに結合した化合物。
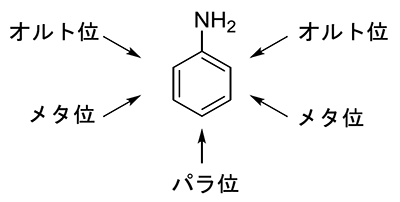
オルト位・メタ位・パラ位:ベンゼン上の位置を示す。アニリンの場合、アミノ基(NH2)から近い順にオルト位、メタ位、パラ位となる。
論文情報
 雑誌名:アメリカ化学会誌(Journal of the American Chemical Society
雑誌名:アメリカ化学会誌(Journal of the American Chemical Society
論文タイトル:Copper-catalyzed Domino [1,3]/[1,2] Rearrangement for the Efficient Synthesis of Multisubstituted ortho-Anisidines
著者:石田恭裕、中村達、寺田眞浩
DOI番号:10.1021/jacs.8b03669
URL:https://pubs.acs.org/doi/10.1021/jacs.8b03669
※この研究成果は表紙にも取り上げられました。
問い合わせ先
<研究に関すること>
東北大学大学院理学研究科化学専攻
准教授 中村 達(なかむら いたる)
電話:022-795-6754
E-mail:itaru-n[at]tohoku.ac.jp
<報道に関すること>
東北大学大学院理学研究科
特任助教 高橋 亮(たかはし りょう)
電話:022-795-5572、022-795-6708
E-mail:sci-pr[at]mail.sci.tohoku.ac.jp
*[at]を@に置き換えてください
Posted on:2018年6月26日