お知らせ

- トップ
- お知らせ
細菌リボソームRNAに対して世界最強の結合力を持つ 非アミノグリコシド系小分子を開発! 副作用が少なく耐性菌にも有効な抗菌薬開発に光
概要
東北大学大学院理学研究科化学専攻・西澤精一教授、佐藤雄介助教のグループは、細菌のリボソーム(注1)活性部位であるリボ核酸(RNA) Aサイトに対して、非アミノグリコシド系分子として世界最強の結合力を持つ蛍光性小分子を開発することに成功しました。
本研究では蛍光性の芳香族化合物(ナフチリジン誘導体)をベースとした小分子(ATMND-C2-NH2)を新規に合成し、ATMND-C2-NH2が、細菌(大腸菌)のタンパク質合成反応場であるRNA Aサイト領域のインターナルループ構造(注2)に強力に結合することを見出しました。また、ATMND-C2-NH2の結合力は、これまでに報告されている最も強い結合力を持つ非アミノグリコシド系分子(MPED)と比べて26倍も強いものであることが分かりました(解離定数Kd = 0.44㎛)。さらに、ATMND-C2-NH2を蛍光指示薬(インジケーター)として用いることで、様々な化合物(抗菌薬候補)のAサイト結合能を簡便かつ安価に評価できる分析法を提案しました。
現在抗菌薬として用いられているアミノグリコシド系分子は薬剤耐性菌や副作用の問題を抱えていますが、本研究で開発したATMND-C2-NH2は、これらの問題を克服した非アミノグリコシド系抗菌薬の開発に向けたリード化合物として、また薬剤探索に向けた分析ツールとして有用であると期待できます。
背景
感染症治療において、細菌のタンパク質合成を阻害するアミノグリコシド系抗生物質が有効な抗菌薬として広く用いられてきました。通常、タンパク質合成はリボソームRNAのAサイトと呼ばれる活性部位にアミノアシル転移RNAが運ばれてくると、メッセンジャーRNAと正しく対合することで、タンパク質合成が開始されます。アミノグリコシド系抗生物質はAサイトのインターナルループ構造に結合し、構造変化を引き起こすことで、アミノアシル転移RNAの選別を阻害します。これにより、細菌は正確なタンパク質合成が行えないようになり、細菌は死滅します。しかし、アミノグリコシド系抗生物質では様々なRNAに結合してしまうことに起因する副作用(腎毒性・聴器毒性)や、アミノグリコシドを化学的に修飾し不活性化してしまう修飾酵素によるアミノグリコシド耐性菌(注3)の出現が大きな問題となってきています。こうした問題を克服する方法として、アミノグリコシド系抗生物質とは構造的に全く異なる分子(非アミノグリコシド系分子)をベースとした抗菌薬開発が注目されています。
研究手法
本研究では大腸菌リボソームRNA Aサイト領域を模倣したモデル(A-site RNA)を用いて、研究グループでこれまでに開発してきた蛍光性の芳香族化合物をスクリーニングしました。これらの化合物は、分子量200~300程度の小分子であり、核酸塩基と相補的な水素結合様式を持っていることから、A-site RNAのインターナルループ構造内の核酸塩基を効果的かつ精密に認識することが期待できます。また、これらの蛍光性小分子化合物は核酸との結合に伴い蛍光強度が大きく変化するため、これをモニタリングすることで、A-site RNA/化合物相互作用を評価できると期待できます。
研究成果
スクリーニングの結果、2-amino-5,6,7-trimethyl-1,8-naphthyridine(ATMND)がA-site RNAに結合できることが分かりました(Kd = 20㎛)。そこで、ATMNDをベースとして置換基導入に伴う構造改良を試みたところ、更に強い結合力を持つATMND-C2-NH2(Kd = 0.44㎛: I = 60 mM, pH 7.0, 5℃)を合成することに成功しました。ATMND-C2-NH2はA-site RNAのインターナルループ構造に対して高い選択性を示し、結合に伴いその蛍光強度は著しく小さくなります。ATMND-C2-NH2の結合力は、これまでに報告されていた最も強い結合力を持つピリジン誘導体(MPED: Kd = 12㎛)よりも26倍強いものです。詳細な相互作用解析の結果、スタッキング相互作用(注4)、水素結合および静電相互作用が協同的に作用することで、ATMND-C2-NH2がA-site RNA インターナルループ構造に結合することが示唆されました。MPEDと比べてATMND-C2-NH2は分子面積が大きいため、核酸塩基とより効果的にスタッキング相互作用を引き起こし、これにより強力な結合力が発現していると思われます。さらに、ATMND-C2-NH2がA-site RNAに強く結合し、蛍光消光を示すという特性に着目し、これを蛍光指示薬として活用する分析法を提案、様々な構造を持つ化合物のAサイト結合機能を簡便かつ安価に評価できることを実証しました。
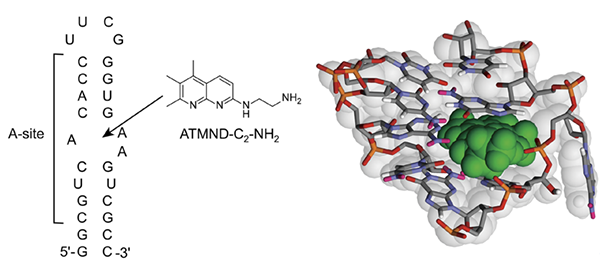
図:大腸菌リボソームRNA AサイトモデルとATMND-C2-NH2の構造式。また、予想される結合様式(緑色: ATMND-C2-NH2)。
今後の展開
本研究で開発したATMND-C2-NH2はそれ自身が非アミノグリコシド系抗菌薬の開発におけるリード化合物になるものと期待できます。さらに、これをインジケーターとして利用する分析法は化合物ライブラリーから候補分子を選定するスクリーニングに有用であるため、非アミノグリコシド系抗菌薬探索を強力に支援する技術として期待できます。こうした展開を進めるために、現在更なる結合機能・蛍光応答機能を改良した蛍光性小分子の開発を進めています。
論文情報
雑誌名: Chemistry-A European Journal
論文タイトル:Fluorescent trimethylated naphthyridine derivative with an aminoalkyl side chain as the tightest non-aminoglycoside ligand for the bacterial A-site RNA
著者:Yusuke Sato, Masafumi Rokugawa, Sho Ito, Sayaka Yajima, Hiroki Sugawara, Norio Teramae and Seiichi Nishizawa
DOI番号:10.1002/chem.201802320
URL:https://onlinelibrary.wiley.com/doi/abs/10.1002/chem.201802320
用語説明
(注1)リボソーム
タンパク質(リボソームタンパク)とRNA(リボソームRNA)から構成される構造で、メッセンジャーRNAの持つ遺伝情報をタンパク質に翻訳する役割を担っている。
(注2)インターナルループ構造
非ワトソンクリック塩基対構造の一種で、天然のRNAに多く見られる二次構造。大腸菌リボソームRNA Aサイトには3つのアデニンから構成されるインターナルループが存在する。
(注3)アミノグリコシド耐性菌
ある種の細菌は、アミノグリコシド系抗生物質の構造を変化させる酵素(アミノグリコシド修飾酵素)を用いることでその抗菌効果を低下させることが知られている。したがって、耐性を持った細菌にはアミノグリコシド系抗生物質が有効に働かなくなる。
(注4)スタッキング相互作用
分子間に働く相互作用の一種。核酸塩基ともう一つの核酸塩基、もしくは核酸塩基に似た構造を持つ分子が垂直方向に積み重なることで安定化される。
問い合わせ先
<研究に関すること>
東北大学大学院理学研究科化学専攻
助教 佐藤 雄介(さとう ゆうすけ)
電話:022-795-6551
E-mail:satoyuu[at]m.tohoku.ac.jp
<報道に関すること>
東北大学大学院 理学研究科
特任助教 高橋 亮(たかはし りょう)
電話:022-795-5572、022-795-6708
E-mail:sci-pr[at]mail.sci.tohoku.ac.jp
*[at]を@に置き換えてください
Posted on:2018年9月27日