お知らせ

- トップ
- お知らせ
強い酸となる飽和炭化水素 〜正電荷が変える分子の性質〜
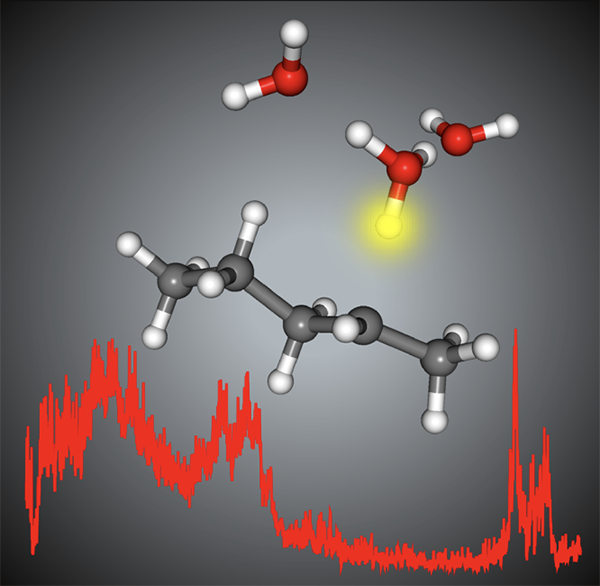
図1. ペンタン陽イオンに水3分子が付着した会合体の構造。ペンタン陽イオンが酸として働いて生じる。
概要
気体として取り出したペンタン(C5H12)の陽イオン(C5H12+)と水分子との会合体の構造を赤外分光で調べたところ、2分子以上の水分子がペンタン陽イオンに付着すると、ペンタンのCHからプロトン(H+、水素イオン)が水側へ移動する酸解離反応が起きることが分かりました。これは通常、酸とは見なされない飽和炭化水素であるペンタンが、陽イオンとなると性質を一変させ、強い酸として働くことを示しています。
研究内容
一般に良く知られている酸とは、水溶液中でプロトン(H+)を放出する(水に与える)ことが出来る化合物を指します(注1)。硫酸(H2SO4)、塩酸(HCl)(注2)、酢酸(CH3COOH)といった代表例から推測できるように、部分構造としてX-H (X = O, N,ハロゲン)を持つことが一般に酸として働く事の出来る化合物の条件となります。これらXは電気陰性度(注3)が水素よりも大きい元素です。そのため、これらのX-H結合では、Xは負に、Hは正に少し帯電し、これがH+の放出を容易にします。ここで、Xが炭素の場合、すなわちC-Hは有機化合物に最も多く含まれる結合です。しかし炭素と水素の間の電気陰性度の差が小さいため、C-H結合における水素の帯電は極めて小さく、結果として通常、C-H結合は酸として働きません。従って、炭素と水素からなり、多重結合を持たない飽和炭化水素(メタン、エタン等)は、水素を多く含んでいても酸と見なされることはありません(注4)。
しかし、実はこのような議論は我々にとって最もなじみ深い分子の状態である中性状態でしか成り立ちません。もし飽和炭化水素の分子をイオン化し、陽イオン(カチオン)としたらどうでしょうか?既に正電荷が存在しているので、それをH+として放出することは中性状態よりもはるかに容易になることが期待できます。すなわち、カチオン状態では飽和炭化水素が酸として働くことが予期されるのです。しかしカチオン状態は反応しやすく、またお互いの電荷が反発するため、極めて薄い濃度でしか存在する事が出来ません。そのため、飽和炭化水素のカチオン状態における酸としての能力を実験的に検証することは困難でした。
私たちは、分子クラスターと呼ばれる、特定個数の分子から成る分子の会合体(分子のかたまり)を気体として生成させ、これに様々なレーザー光を照射してその構造や性質を明らかにする研究を行ってきました。この手法を飽和炭化水素の一種であるペンタン(C5H12)に適用し、ペンタンカチオン(C5H12+)に特定個数の水分子を付着させた場合に、どのような構造になるのかを調べました。図2(a)に示したのは、ペンタンカチオンに水が3分子付着した[C5H12-(H2O)3]+クラスターの赤外スペクトルです。赤外スペクトルとは、可視光よりも長い波長の光(赤外光)吸収の波長依存性を示すものです。赤外光の吸収は分子の化学結合が伸びたり縮んだりするような振動運動と密接に関連しており、分子のある部位の振動が特定の波長の吸収によって引き起こされます。そのため、どのような波長が吸収されるかを調べることにより、分子の振動の様子を知ることが出来ます。さらに分子の振動はその分子の構造によって決まるので、分子振動の様子を知ることにより分子の構造の情報を得ることが可能となります。ペンタンカチオンに水が3分子付着しているとき、安定な構造としてどのようなものがあるかは、量子化学計算(注5)という手法で理論的に予測でき、それぞれの構造に対応する赤外吸収スペクトルも同時に理論計算ができます。その結果を図2(b), (c)に示します。(b)では、ペンタンカチオンからH+が水分子側へ移動し、C5H11がヒドロニウムイオン(H3O+)を中心としたプロトン付加水クラスターH3O+(H2O)2と分子間力で結びついた構造になっています。一方、(c)はペンタンカチオンに水が3分子付いている構造です。図に見えるスペクトルは主に水側のOHの伸縮振動に対応する赤外光の吸収を示しています。この観測された赤外光吸収のスペクトルは、水がH+を得た(b)の構造により良く再現されますが、ペンタンカチオンがH+を保持している(c)構造では実測とは全く異なるスペクトルとなってしまいます。すなわち、ペンタンカチオンに水3分子を付着させると、ペンタンカチオンは酸解離を起こし、水にH+を放出する事がこの測定から実証されました。同様の観測を水1分子、2分子についても行いました。その結果、水1分子の付着では酸解離が完全には起きず、H+がペンタンと水との間で共有される状態になるが、水2分子の付着で完全な酸解離が起きる事が分かりました。水の個数によりH+の移動の有無が変わるのは、水分子の個数が増えると、移動したH+をエネルギー的により安定化させることが出来るためです。すなわち、H+が移動するために必要最小限の水分子の個数は、H+を渡す能力(酸性度)の高低を表します(水の個数が少ないほど、酸性度が高い)。過去の研究により、OH基を持つ酸であるフェノール(注6)のカチオンでは、OH基からのH+の移動に水3~4分子が必要であるという結果が分かっています。ペンタンカチオンは僅か水2分子でH+を渡してしまうので、フェノールの約半分の水しか必要としないことになり、これはペンタンカチオン(のCH)がフェノールカチオン(のOH)よりも酸性度が高い、ということを示しています。すなわち、正電荷は分子の性質を一変させ、通常酸とは見なせない飽和炭化水素を強い酸に変える事が分かりました。
発表雑誌
この研究は東北大学の松田欣之助教、藤井朱鳥准教授らの研究グループにより行われました。研究成果はアメリカ化学会発行の学術雑誌である「The Journal of Physical Chemistry Letters」8巻に掲載されました。
Tomoya Endo, Yoshiyuki Matsuda, Asuka Fujii, "Infrared Spectroscopic Study of the Acidic CH Bonds in Hydrated Clusters of Cationic Pentane" J. Phys. Chem. Lett. 2018, 8, 4716-4719.
参考図
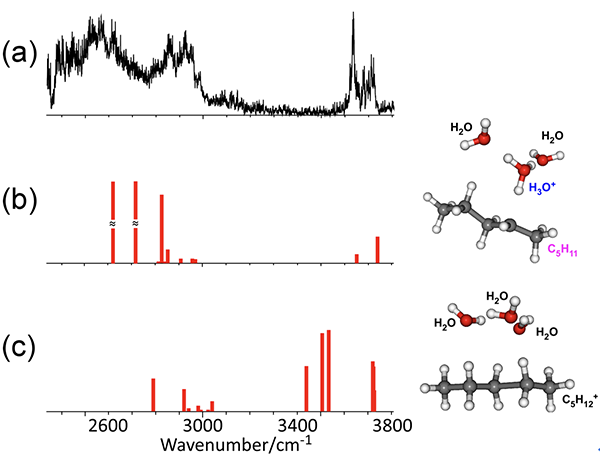
図2. (a)水3分子が付着したペンタンカチオンの赤外スペクトル、(b)-(c) 水3分子が付着したペンタンカチオンの安定構造と振動計算の結果。J. Phys. Chem. Lett. 2018, 8, 4716.から引用
用語解説
(注1) 酸
酸の定義は複数あり、ここではアレニウスによる定義を採用しています。
(注2) 塩酸
正確には塩化水素(HCl、常温常圧では気体)の水溶液が塩酸です。
(注3) 電気陰性度
分子内の原子が電子を引きつける強さを相対的に表したもの。これが大きな原子は結合している異種の原子から電子を部分的に奪って負に帯電し、小さな原子は逆に電子を与えて正に帯電する傾向を示します。
(注4) CH結合の酸性度
二重結合や三重結合を持つ炭化水素(不飽和炭化水素)では、多重結合(特に三重結合)を持つ炭素に結合したCHは例外的にやや強く分極し、弱い酸として働くことが知られています。
(注5) 量子化学計算
車や天体などの運動はニュートン力学(古典力学)と呼ばれる法則に従っており、私たちの日常の感覚もこれに沿っています。しかし原子・分子などの極微の世界は、ニュートン力学とは異なる原理によって支配されており、これを量子力学と呼びます。量子力学に基づいて化学の問題を取り扱う分野を量子化学と呼び、シュレディンガー方程式と 呼ばれる基本方程式を数値的に解くことにより、様々な化学現象の理論的な予言を可能にしています。
(注6) フェノール
フェノールはベンゼン(C6H6)のひとつの水素原子をOH基で置換した有機化合物であり、C6H5OHという構造を持ちます。
問い合わせ先
東北大学大学院理学研究科 化学専攻
准教授 藤井 朱鳥(ふじい あすか)
電話:022-795-6572
E-mail:asuka.fujii.c5[at]tohoku.ac.jp
*[at]を@に置き換えてください
Posted on:2018年10月 3日