お知らせ

- トップ
- お知らせ
脂質膜の曲率に応答する蛍光プローブ 〜細胞外小胞解析の新ツール〜
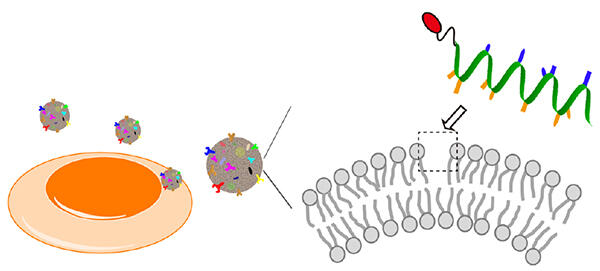
細胞から放出されるエクソソームの高曲率性膜に応答する蛍光プローブの開発。プローブは脂質パッキング欠損(点線で囲った領域)に結合する。
概要
エクソソームと呼ばれる直径100 nm程度の小さな小胞にある高い曲率性脂質膜を認識し、蛍光応答を示す新しいタイプの蛍光プローブ(注1)を開発しました。このプローブは様々な種類のエクソソームに適用できる汎用性を示すことを実証しました。
研究内容
生体内では様々なサイズで多彩な生体分子を含む小胞が常に生成されており、これらは様々な生命現象や疾患などに関与しています。このうちエクソソームと呼ばれる直径50-150nmの小胞は、ほぼ全ての細胞から放出されており、その表面や内部に含むタンパク質・核酸・代謝物などを運搬する役割を果たしています。エクソソームは細胞の種類や状態を反映した情報を持つため、新しいバイオマーカーとして期待されています。現在、エクソソームの解析には、タンパク質の解析で使用されている抗体法が用いられていますが、放出細胞により表面性質が大きく変化してしまうエクソソームを標的とした場合、この方法で検出できるものは抗体が認識する標的タンパク質(マーカー)が現れているものに限定されてしまいます。
私たちは、あらゆる種類のエクソソームに適用しうる新しい分析技術の開発を目的として、これまでの手法の弱点を克服した、エクソソーム全般に共通する表面の高曲率性膜を認識できる蛍光プローブを設計しました。一般に細胞膜のような直径が数µm程度の比較的大きな生体膜の場合、それは、脂質分子が整った(パッキングされた)二重膜構造を取りますが、直径が100 nm程度まで小さくなると、その高い膜曲率のため膜を構成する脂質二重膜の整列が乱れた構造が現れることが知られています(図1)。私たちはこうした「脂質パッキング欠損」と呼ばれる構造に結合する蛍光プローブを開発することを目指して、この構造に対する結合モチーフである「両親媒性α-ヘリックスペプチド(AHペプチド)」を用いることにしました。AHペプチドはα-ヘリックス構造(注2)を取ると、疎水性アミノ酸と親水性アミノ酸が同一平面になるような特徴を持っており、このうち疎水性アミノ酸で構成される面が脂質パッキング欠損に結合することが可能です(図2)。私たちはAHペプチドとしてアポリポプロテインA-Iタンパク質(注3)のC末端領域にある22残基(ApoC)を選び、さらにApoCが結合する反応を蛍光応答として出力するために、ペプチドのN末端に環境応答性蛍光色素であるNile Red(NR)を連結したプローブApoC-NRを設計し、合成しました(図2)。
エクソソームを模した合成リポソーム(注4)を用いてApoC-NRの機能を評価したところ、リポソームの曲率が高くなるにつれて蛍光強度が増加することが分かりました(図3)。NRだけからなる分子の場合、こういった曲率依存性は見られないことから、これは高曲率性膜で多く現れる脂質パッキング欠損をApoC部位が認識していることが分かります。これまでにも高曲率膜選択的なペプチドプローブは数例報告されていますが、これらは主に静電相互作用による結合反応を用いたものであるため、曲率選択性はほとんど現れていませんでした。このことから、結合部位としてAHペプチドを用いて脂質パッキング欠損を狙うことが、高曲率膜選択性に重要であることが分かります。ApoC-NRは実サンプルであるK562細胞(白血病細胞株)由来エクソソーム添加に伴い明瞭な発蛍光応答を示し、105個/µL程度のエクソソーム検出が可能であり、これまでの抗体法(ELISA(注5))と同程度の検出感度を示すことがわかりました。一方、検出までに少なくとも3時間以上必要なELISAと比べて、私たちの蛍光プローブを用いた手法では5分以内に測定可能です。さらに、複数の細胞由来エクソソームを用いた検討から、ApoC-NRはエクソソームの種類、つまり表面のタンパク質発現量が大きく異なる種類に対しても同程度の検出が可能であることが分かりました。これはタンパク質発現量に依存する抗体法とは明確に異なる点で、本手法が高い汎用性を持つ分析技術であることが実証できました。これにより、異なる細胞種類や細胞状態から放出されるエクソソームを正しく迅速に解析できる新たな技術として有用であると期待できます。現在、プローブ機能の改良や体液中に含まれるエクソソーム解析に基づく疾患診断法としての利用について更なる研究を進めています。
発表雑誌
この研究はJST さきがけならびに科学研究費補助金のサポートを受け、東北大学の佐藤雄介准教授らの研究グループにより行われました。研究成果はイギリス王立化学会の学術雑誌である「RSC Advances」10巻に掲載されました。
参考図
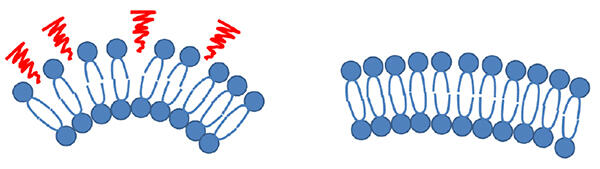
図1:曲率の高い膜(左)は曲率の小さい膜(右)と比べて脂質パッキング欠損(赤)が多く現れる。
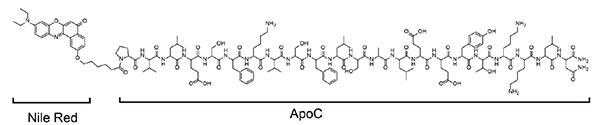
図2:ApoC-NRの構造。ApoCペプチド(配列:PVLES FKVSF LSALE EYTKK LN, 左→右がN末端→C末端を示す)にNRを連結することで合成した。
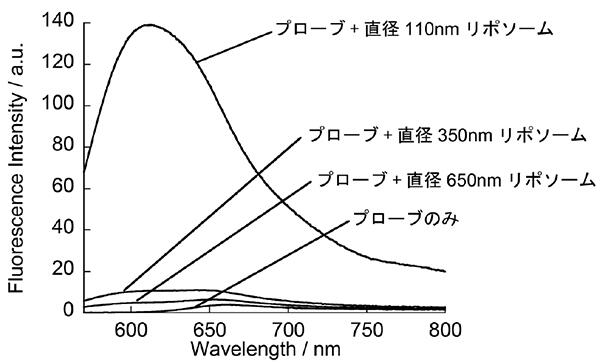
図3:ApoC-NRの合成リポソームに対する蛍光応答。直径の小さい高曲率性膜を持つリポソームに対して選択的にプローブの蛍光強度が増加する。
用語説明
(注1) 蛍光プローブ
標的の分子や特定の構造に結合したり、反応したりすること自身の蛍光強度や蛍光波長が変化する分子のことで、標的の検出や性質変化を評価するのに有用なツールです。
(注2) α-ヘリックス構造
タンパク質の取る二次構造の一つ。1回転の長さが5.4Åで、3.6個のアミノ酸残基に相当するらせん構造です。
(注3) アポリポプロテインA-Iタンパク質
高密度リポタンパク質(HDL)の主要な構成タンパク質で、コレステロール代謝に重要な役割を果たしている。このうち、C末端にある領域は様々な生体膜と結合する機能がある。
(注4) 合成リポソーム
脂質二重膜を持つ球状の小胞。押し出し法や超音波処理などにより、直径がある程度揃った小胞を調製することができる。
(注5) ELISA
酵素結合免疫吸着検査法Enzyme linked immunosolvent assayの略。エクソソーム解析では、エクソソームの表面にあるタンパク質を認識する抗体が固定化された基板上でエクソソームを捕捉した後に、別途酵素などを標識した抗体を用いて検出する手法。基板で捕捉されない分子や過剰の標識化抗体を洗浄する必要がある。
問い合わせ先
東北大学大学院理学研究科 化学専攻
准教授 佐藤雄介(さとう ゆうすけ)
電話:022-795-6551
E-mail:yusuke.sato.a7[at]tohoku.ac.jp
*[at]を@に置き換えてください
Posted on:2021年1月25日