お知らせ

- トップ
- お知らせ
誕生途上のタンパク質が立体構造を形成する新たな仕組みを解明 ~翻訳合成途上タンパク質に働きかける酵素を一分子レベルで可視化することに成功~
発表のポイント
● 翻訳合成途上のタンパク質(新生鎖)へのジスルフィド結合注1導入を検出するシステムを独自に開発した。
● 高速原子間力顕微鏡注2を用いた観察により、PDIファミリー酵素注3が新生ポリペプチド鎖(新生鎖)注4を認識・結合する様子を一分子レベルで可視化することに成功した。
● 代表的な二つのPDIファミリー酵素であるPDIとERp46間で、新生鎖に作用する機構、タイミング、効率が異なることを発見し、両酵素の機能の違いが明らかとなった。
概要
タンパク質の合成や折りたたみがうまくできなくなると、神経変性疾患や糖尿病などの原因となることが知られていますが、合成途上のタンパク質が「正しい」立体構造を形成するしくみについての理解は進んでいませんでした。東北大学多元物質科学研究所の平山千尋博士課程学生、稲葉謙次教授(生命科学研究科、理学研究科化学専攻 兼担)、東北大学学際科学フロンティア研究所の奥村正樹助教、兵庫県立大学大学院工学研究科の今高寛晃教授、町田幸大准教授、大阪大学ナノサイエンスデザイン教育研究センターの野井健太郎特任助教(常勤)、および熊本大学大学院生命科学研究部の小椋光特任教授(研究当時:熊本大学発生医学研究所教授)らを中心とした共同研究グループは、リボソーム注5による新生ポリペプチド鎖(新生鎖)の翻訳合成中にPDI (Protein Disulfide Isomerase) ファミリー酵素であるPDIとERp46が作用する様子を、独自に開発した検出システムおよび高速原子間力顕微鏡を用いて、世界で初めて観察することに成功しました。これにより、細胞内タンパク質恒常性維持に関する重要な知見が得られました。
本成果は、2021年3月9日、米国科学誌iScienceにオンライン掲載されました。
研究背景
真核生物において、リボソームで翻訳合成されたタンパク質の約30%は小胞体内に挿入されます。小胞体中で、翻訳中もしくは翻訳後のタンパク質はシステイン残基間の共有結合であるジスルフィド結合の形成を伴うタンパク質の折り畳み反応、すなわち酸化的フォールディングを経て、生理的機能を持つ「正しい」立体構造を獲得します。小胞体内では20種類以上のPDIファミリー酵素が翻訳後のタンパク質の酸化的フォールディングを触媒していることが過去の研究によって報告されています。しかし、各PDIファミリー酵素が翻訳のどの段階でどのような機構で翻訳合成途上のタンパク質(以下、新生鎖)に作用するのかを直接的に検出する方法が確立されていなかったため、細胞内での翻訳と同時に起こる酸化的フォールディングの詳細な分子機構に関する理解は進んでいませんでした。
研究内容と成果
本研究ではまず、翻訳合成途上の新生鎖を準備するために、再構成型タンパク質翻訳システムを用いて目的の長さで翻訳停止したリボソーム―新生鎖複合体 (Ribosome-Nascent chain Complex : RNC)を調製しました。このRNCを利用し、主に以下の2つのアプローチを用いて、代表的な二つのPDIファミリー酵素(PDIとERp46)の新生鎖に対する作用機構の解析を進めました。
① 新生鎖へのジスルフィド結合導入モニタリングシステムの開発と利用(生化学的手法)
独自に開発した検出システムを用いて、PDIとERp46が新生鎖に対し、経時的にジスルフィド結合を導入する様子を観察することに成功しました(図1)。その結果、新生鎖へのジスルフィド結合導入においてERp46はPDIよりも優れた能力をもつこと、PDIおよびERp46によるジスルフィド結合導入効率はリボソーム出口からジスルフィド結合を形成するシステインペアまでの距離に依存することが明らかとなりました。また、PDIの基質結合において重要とされる疎水性ポケットの変異体を用いて実験を行ったところ、予想に反し、野生型に比べてジスルフィド結合を効率よく導入する様子が観察されました。これは、疎水性ポケットが新生鎖の結合に関与することを示す一方、この結合によってジスルフィド結合導入のサイクルが遅くなったことを示唆します。すなわち、疎水性ポケットをもたない酵素の場合、基質との結合が一過的になり、その結果、高効率のジスルフィド結合導入が可能になったと解釈されます。
② 高速原子間力顕微鏡によるRNCに作用するPDIファミリー酵素の一分子観察 (生物物理学的手法)
PDIおよびERp46がRNCと結合する様子を一分子レベルで可視化するため、0.1 secの時間分解能とnmレベルでの空間分解能を有する高速原子間力顕微鏡(HS-AFM)を用いた解析を行いました。RNC固定化マイカ表面に各PDIファミリー酵素を添加し観察を行った結果、PDIは二量体を形成することで新生鎖に60秒以上安定して結合する様子が観察されました。一方ERp46は、PDIと異なり、単量体の状態で10~20秒間程度、新生鎖に結合することが明らかとなりました(図2)。また、基質結合能が低下したPDI変異体を用いて同様の観察を行ったところ、PDI野生型のような長時間の新生鎖への結合が観察できず、ERp46のように短時間結合することが明らかとなりました。
本研究において、無細胞タンパク質合成系を用いた生化学実験と高速AFMを用いた一分子観察実験を組み合わせることにより、ERp46は新生鎖の翻訳初期の段階で一過的に結合し、ジスルフィド結合を効率よく導入する一方、PDIは新生鎖の翻訳合成がより進んだ時点で自身が有する疎水性ポケットを介して新生鎖と結合し、ERp46よりも遅い速度でジスルフィド結合を導入することが明らかとなりました。以上の結果は、新生鎖の伸長に伴うジスルフィド結合の導入反応において、ERp46とPDIが異なる役割を持つことを示唆しており、両酵素の新生鎖に対する異なる作用機序について新たなモデルを提唱するに至りました(図3)。
今後の展開
本研究では、再構成型タンパク質翻訳システムを採用し、翻訳停止したRNCを用いて解析を行いましたが、本来、新生鎖は小胞体膜中に存在するタンパク質膜透過装置(Sec61トランスロコンチャネル)を介して小胞体内腔に挿入されます。そこで、このトランスロコンチャネルがPDIファミリー酵素による新生鎖の酸化的フォールディングにどのように関与するかは未解明の問題として残されています。また、本研究によって得られた知見を細胞内での現象の解明につなげるため、各PDIファミリー酵素がどの基質に対して、どこまで伸長した時にジスルフィド結合を導入するのかを網羅的に解析する必要もあります。
新生鎖のフォールディング補助機構の解明は、現在も国内外で活発に研究されている細胞内タンパク質恒常性維持に関する重要な知見の提供につながると期待しています。タンパク質恒常性維持機構の破綻はアルツハイマー病やハンチントン病等の神経変性疾患や糖尿病等の原因となることが知られていることからも、本研究内容は基礎分子生物学のみならず医学的にも重要な知見を与えていると言えます。
発表論文
著 者:Hirayama, C., Machida, K., Noi, K., Murakawa, T., Okumura, M., Ogura, T., Imataka, H. and Inaba, K.*
タイトル:Distinct roles and actions of protein disulfide isomerase family enzymes in catalysis of nascent-chain disulfide bond formation
雑誌名 :iScience
DOI :https://doi.org/10.1016/j.isci.2021.102296
用語説明
(注1)ジスルフィド結合
タンパク質中の2つのシステイン残基が2電子酸化を受けることによって形成される、硫黄原子間の共有結合。タンパク質立体構造の形成、安定化に寄与する。
(注2)高速原子間力顕微鏡
基板に固定した分子を、針でタップしながら高速に走査することで、分子の形状と動きを一分子レベルでリアルタイムに可視化することが可能なナノテクノロジー。
(注3)PDIファミリー酵素
ジスルフィド結合の形成、組み換え、開裂を触媒する小胞体中に存在する酵素群のこと。哺乳動物細胞の小胞体内腔では、20種類以上ものPDIファミリー酵素が存在する。
(注4)新生ポリペプチド鎖(新生鎖)
リボソームによって合成途上の、アミノ酸が連なった新生タンパク質。
(注5)リボソーム
細胞内でmRNAに刻まれた塩基配列情報をもとにタンパク質の合成を行う、RNAとタンパク質からなる超分子複合体。
参考図
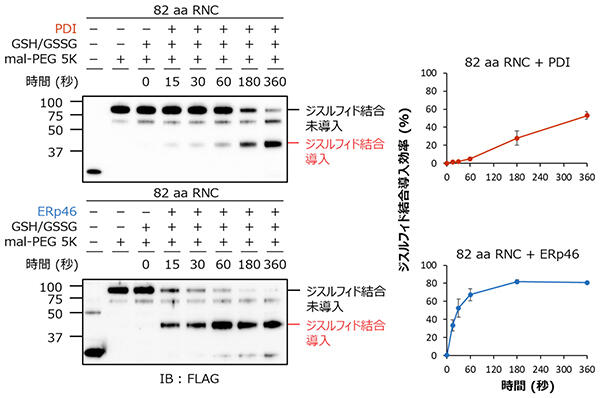
図1:PDIおよびERp46による新生鎖へのジスルフィド結合導入の検出
PDIとERp46が経時的に新生鎖にジスルフィド結合を導入する様子が観察できる。ERp46がPDIよりも効率的にジスルフィド結合を導入していることから、ERp46がPDIに比べて優れたジスルフィド結合導入酵素として機能することが明らかとなった。
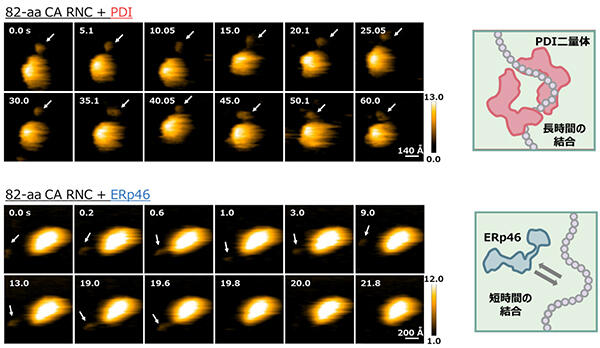
図2:高速原子間力顕微鏡観察により明らかとなった新生鎖に対するPDIとERp46の結合様式の違い
PDIは二量体を形成し新生鎖に長時間結合するのに対し(上図)、ERp46は単量体で新生鎖に短時間結合する様子 (下図)が観察された。
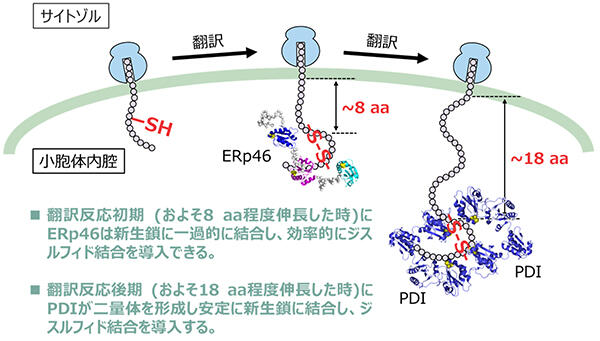
図3:新生鎖に作用するPDIとERp46の異なる作用機序
ERp46は新生鎖の翻訳反応初期に一過的に結合し、効率よくジスルフィド結合を導入する。一方、PDIは二量体を形成し、翻訳合成後期に中央の溝に新生鎖を安定に取り込むことで、ジスルフィド結合を導入する
問い合わせ先
<研究に関すること>
東北大学 多元物質科学研究所 教授
(生命科学研究科、理学研究科化学専攻 兼担)
稲葉 謙次(いなば けんじ)
〒980-8577 宮城県仙台市青葉区片平2丁目1-1
Tel: 022-217-5604
E-mail: kenji.inaba.a1[at]tohoku.ac.jp
*[at]を@に置き換えてください
Posted on:2021年4月 2日