お知らせ

- トップ
- お知らせ
膜ポンプによる膜輸送機構の普遍的概念の提唱
~クライオ電子顕微鏡によるヒト由来カルシウムポンプの 新たな反応中間状態の同定と構造決定~
発表のポイント
● クライオ電子顕微鏡構造解析により、細胞中のカルシウムの恒常性維持に重要な小胞体膜局在カルシウムポンプSERCA2b注1の新たな三つの反応中間状態を同定し、構造決定した。
● SERCA2bの各反応中間状態には複数のコンフォメーション注2が存在し、その一つは次の反応中間状態のコンフォメーションに酷似することを明らかにした。
● SERCA2bがコンフォメーションをオーバーラップさせながら次の反応中間状態に遷移することを発見し、膜ポンプによる膜輸送機構の普遍的概念を提唱した。
概要
細胞内小器官の一つである小胞体は、カルシウムを取り込み貯蔵することで細胞内カルシウムイオン濃度を適切に維持しています。SERCA2bは筋収縮の制御、神経伝達、アポトーシスの誘導、タンパク質の品質管理など、様々な生命現象において重要な役割をもつ細胞内カルシウムイオンの恒常性を保つ上で必須の小胞体膜局在カルシウムポンプです。しかし、これまでは一部の反応中間状態の構造しか決定されていませんでした。
東北大学多元物質科学研究所の張 玉霞 前助教、蔡 笑寒 博士課程学生、渡部 聡 助教、稲葉 謙次 教授(生命科学研究科、理学研究科化学専攻 兼担)、理化学研究所 計算科学研究センターの小林 千草 技師、同開拓研究本部 杉田 有治 主任研究員(計算科学研究センター チームリーダー 兼任)、および東京大学大学院医学系研究科の包 明久 前特任助教、吉川 雅英 教授らを中心とした共同研究グループは、SERCA2bの新たな反応中間状態の高分解能構造を、クライオ電子顕微鏡単粒子解析注3という技術を用いて決定しました。詳細な構造解析の結果、SERCA2bの各反応中間状態には複数のコンフォメーションが存在し、それぞれが互いにオーバーラップさせながら反応中間状態の間を遷移するという新たなメカニズムを発見しました。このメカニズムはSERCA2bに限らず、他の膜ポンプや酵素においても普遍的に働いている可能性が考えられます。
本研究成果は、2022年12月6日11時(米国東部時間)に米国雑誌Cell Reportsオンライン版に掲載されました。
研究の背景
小胞体は膜タンパク質や分泌タンパク質の生合成やカルシウムの貯蔵を行う細胞内小器官です。小胞体膜にはATP駆動型カルシウムポンプであるSERCAが存在し、細胞質から細胞内小器官を除いた部分であるサイトゾルから小胞体内へのカルシウム取り込みを行います。小胞体膜には、イノシトール三リン酸受容体やリアノジン受容体というカルシウムチャネルが存在し、SERCAと協同して、小胞体内および細胞内のカルシウム濃度の恒常性維持を司っています。SERCA2bは、筋肉組織特異的に発現するアイソフォーム注4のSERCA1aやSERCA2aとは異なり、全組織に発現しています。
これまでに研究グループは、SERCA2bの(i)カルシウムのみが結合しATPが結合する前の状態(ii)カルシウムとATPが共に結合した状態、(iii)ATP加水分解後リン酸基が結合しカルシウムが解離した状態については、クライオ電子顕微鏡およびX線結晶構造解析による構造解析を行ってきました。しかしながら、SERCA2bには他にも複数の反応中間状態があると考えられ、上記の三つの構造情報のみではSERCA2bが駆動するカルシウムポンプサイクルの全容解明には至りませんでした。そこで本研究では、SERCA2bの他の三つの中間状態、すなわち(iv)ATP加水分解後リン酸基とカルシウムが結合した状態、(v)カルシウムが解離しリン酸基との共有結合が開裂する前の状態、(vi)カルシウムが解離しリン酸基との共有結合が開裂した直後の状態のクライオ電子顕微鏡による構造解析を行いました。さらに、得られた構造情報を用いて分子動力学シミュレーションを行い、リン酸基とカルシウムが結合した状態からカルシウムが解離しリン酸基との共有結合が開裂する前の状態に至るまでの構造変化を原子レベルで追跡しました。
研究の内容と成果
本研究ではまず、SERCA2bの高分解能構造をクライオ電子顕微鏡単粒子解析法により決定するために、十分に精製されたSERCA2b試料を用いて複数の反応中間状態を調製し、東京大学大学院医学系研究科に設置されているハイエンドクライオ電子顕微鏡装置Titan Krios(ThemoFisher製)を用いて、データ収集を行いました。その結果、カルシウムイオンとリン酸基が結合した状態については3.4 Ä分解能で、カルシウムが解離しリン酸基との共有結合が開裂する前の状態については3.0 Ä分解能で、カルシウムが解離しリン酸基との共有結合が開裂した直後の状態については3.2 Ä分解能で、それぞれ構造決定しました(図1)。得られた新しい反応中間状態の構造情報から、SERCA2bのカルシウムポンプサイクルにおいて、Aドメイン(駆動ドメイン)、Nドメイン(ATP結合ドメイン)、Pドメイン(リン酸化ドメイン)の三つの細胞質ドメインと、11個の膜貫通ヘリックス(N末端からTM1~TM11と呼ぶ)の配置が互いに連動する形で変化していることが分かりました(図2)。
興味深いことに、カルシウムイオンとリン酸基が結合した状態のクライオ電子顕微鏡マップを解析したところ、多くの粒子はカルシウムをリリースした状態にあり、その構造は過去に研究グループが解いたカルシウム非結合、リン酸基結合型の構造とほぼ同一でした(図2)。次に、カルシウムが解離しリン酸基との共有結合が開裂する前の状態についてクライオ電子顕微鏡データを詳細に解析したところ、小胞体内腔側のカルシウムの出口が開いたコンフォメーションと少し狭くなったコンフォメーションの二種類存在することが明らかとなりました(図3)。さらに、カルシウムが解離しリン酸基との共有結合が開裂した直後の状態については、このカルシウムの出口が完全に閉じており、上述の出口が狭くなった方のコンフォメーションと類似していました(図3)。
過去に研究グループは、カルシウムが結合しATPが結合する前の状態のクライオ電子顕微鏡構造を報告しており、その状態においても細胞質側ドメインが大きく開いたコンフォメーションと閉じたコンフォメーションの二種類存在し、閉じた方のコンフォメーションはATPが結合したコンフォメーションと類似していることを発見しました。このように、クライオ電子顕微鏡単粒子解析という各粒子の様々な角度からの二次元透過像をもとに分類・平均化し構造決定するという技術を用いることで、SERCA2bの各反応中間状態にはコンフォメーションが異なる複数のサブステートが存在することが示されました。さらに興味深いことに、サブステートの一つの構造は、次の反応中間状態のサブステートの構造と一致、もしくは酷似しており、反応中間状態間の遷移がコンフォメーションを互いにオーバーラップさせることで促進されていることが示唆されました(図4)。このことはSERCA2bに限らず他の膜ポンプにおいても共通でみられる性質であると推測され、膜ポンプによる膜輸送機構の普遍的なメカニズムとして新たな学説を提唱するに至りました。
今後の展開
本研究を通し、SERCA2bの新たな三つの反応中間状態のクライオ電子顕微鏡構造を解き、各反応中間状態においてコンフォメーションが異なる複数の状態があることを発見しました。従来の構造決定手法であるX線結晶構造解析注5では試料を結晶化するというバイアスがあるため、それによりタンパク質の構造も一つに収束する傾向があります。一方クライオ電子顕微鏡では、タンパク質試料を結晶化する必要はなく、溶液中の各粒子の構造をより直接的に可視化し、構造が異なる粒子を分類して平均化することで、複数の異なる構造を一度のデータ収集から同定および決定することが可能です。
研究グループは今後、本研究を通して提唱するに至った、各反応中間状態には構造多型性があり、各中間状態間でコンフォメーションをオーバーラップさせながら遷移が起こるという酵素反応機構の概念を、より一般化させることが重要と考えています。そのために、膜ポンプに限らず、様々な酵素の反応中間状態の構造をクライオ電子顕微鏡により詳細に解析・比較し、中間状態間のコンフォメーションのオーバーラップの可能性について、より広く深く追究していきたいと考えています。
SERCA2bの遺伝子変異による機能不全がダリエ病注6という皮膚病を引き起こすことが広く知られ、また小胞体中のカルシウム恒常性維持の破綻が小胞体ストレスを誘起し、ひいては神経変性疾患や糖尿病を引き起こすことが知られています。したがって、本研究で得られた基礎的知見は、細胞内カルシウムが関わる種々の生命現象の解明のみならず、細胞のカルシウム恒常性維持機構の破綻が引き起こす様々な疾病の原因解明および治療戦略の開発にもつながることが期待されます。
本成果は、以下の事業・研究課題の支援によって得られました。
日本医療研究開発機構(AMED)革新的先端研究開発支援事業(AMED-CREST)
課題名:ケミカルプロテオスタシス:レドックス、pH、金属イオンが織りなすタンパク質品質管理機構の研究開発
代表者:稲葉 謙次(東北大学 多元物質科学研究所 教授)
課題番号:21gm1410006h0001
日本医療研究開発機構(AMED)創薬等ライフサイエンス研究支援基盤事業(BINDS)
課題名:クライオ電顕による細胞内ネイティブ複合体構造解析
代表者:吉川 雅英(東京大学 大学院医学系研究科 教授)
課題番号:JP19am0101115
学術振興会科学研究費補助金学術変革領域(A)「クロススケール新生物学」
課題名:クロススケール細胞内分子構造動態解析が解明する小胞体恒常性維持機構
代表者:稲葉 謙次(東北大学 多元物質科学研究所 教授)
課題番号:JP21H05253
課題名:クロススケール細胞内分子構造動態の実験データ融合モデリング
代表者:杉田 有治(理化学研究所 開拓研究本部 主任研究員)
課題番号:JP21H05249
課題名:クロススケール In-cell cryo-ET技術の開発と上皮組織への応用
代表者:吉川 雅英(東京大学 大学院医学系研究科 教授)
課題番号:JP21H05248
論文情報
著者:Zhang. Y., Kobayashi, C., Cai, X., Watanabe, S., Tsutsumi, A., Kikkawa, M., Sugita, Y. and Inaba, K.*
タイトル:Multiple sub-state structures of SERCA2b reveal conformational overlap at transition steps during the catalytic cycle
雑誌名:Cell Reports
DOI: 10.1016/j.celrep.2022.111760
参考図
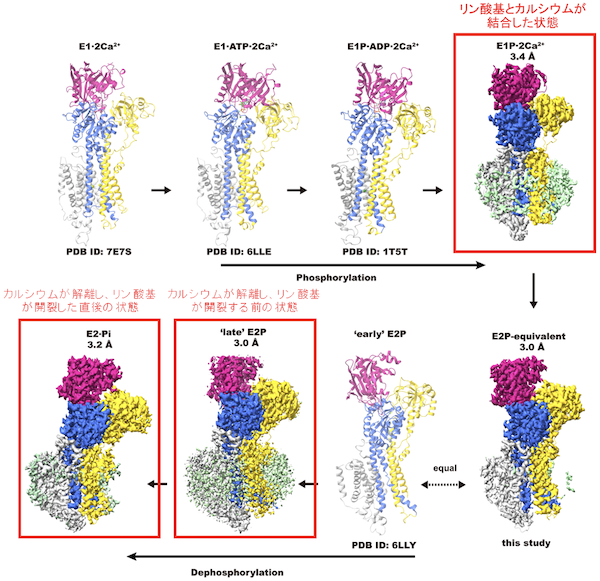
図1:ヒト由来小胞体カルシウムポンプSERCA2bの反応サイクル中に生じる中間状態と本研究により同定された新たな反応中間状態
本研究で新たに同定されたSERCA2bの反応中間状態のクライオ電子顕微鏡構造を赤四角で囲い、表示している。我々の過去の研究により解かれたSERCA2bの構造についてはリボン表示し、図の下にプロテインデータバンク(PDB)に登録されているID番号を記している。
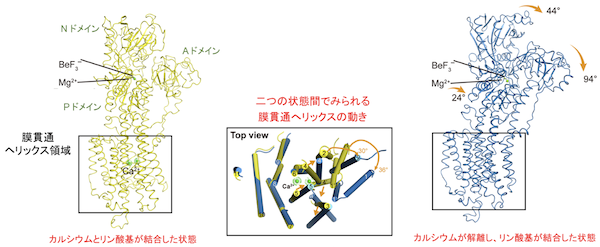
図2:本研究により決定されたカルシウムとリン酸基が結合した中間状態(左)とカルシウムが解離しリン酸基のみが結合した中間状態(右)のSERCA2bのクライオ電子顕微鏡構造
これら二つの構造の比較により、カルシウムイオンの解離に伴い、サイトゾル側の三つのドメイン(A, N, Pドメイン)の配置が大きく変化し、また膜貫通ヘリックスの位置と方向も動くことが示された。これら二つの構造は、一つのクライオ電子顕微鏡データセットから同定された構造であり、カルシウムとリン酸基が結合した状態はエネルギー的に不安定であり、カルシウム存在下においてもカルシウムが解離した状態(右の状態)が主成分として存在することが示された。
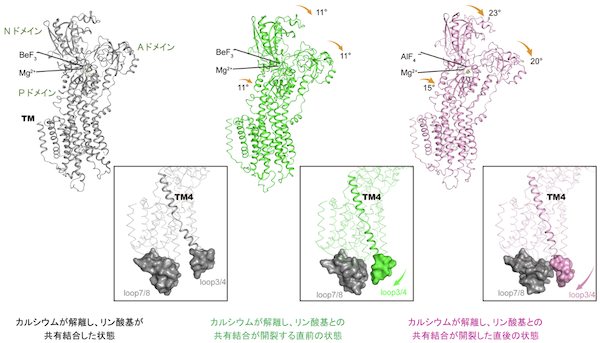
図3:本研究により明らかとなったリン酸基との共有結合の開裂に伴うSERCA2bの構造変化
カルシウムが解離し、リン酸基が共有結合した状態(左)とカルシウムが解離し、リン酸基との共有結合が開裂した状態(右)との間には、もう一つの中間状態(真中)が存在することが本研究により示された。この構造転移の過程で、Loop 3/4とLoop7/8によって構成されるカルシウムイオンの出口が閉じる様子が観察され、新たに見つかった反応中間状態の構造(真中)はリン酸基との共有結合が開裂した状態(右)に近づいていることが示された。
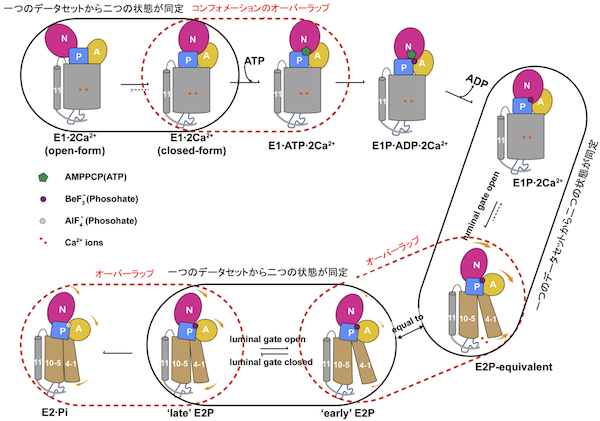
図4:本研究により明らかとなったSERCA2bの反応サイクルにおける反応中間状態間のコンフォメーションのオーバーラップ
黒の楕円は、一つのクライオ電子顕微鏡のデータセットから同定された構造が有意に異なる二つサブステートを示す。赤の点線の楕円は、異なる反応中間状態間でみられるコンフォメーションのオーバーラップ。SERCA2bは、このコンフォメーションのオーバーラップを利用し、中間状態間の遷移を促進していると考えられる。
用語説明
注1)小胞体膜局在カルシウムポンプSERCA2b
小胞体は細胞内小器官の一つであり、その機能の一つにカルシウムの貯蔵がある。小胞体膜に存在するSERCA2bは、細胞質から小胞体内へカルシウムを取り込む役割があり、細胞内および小胞体内のカルシウム濃度の恒常性維持において中心的役割を担う膜ポンプである。他のアイソフォームであるSERCA1aやSERCA2aは骨格筋や心筋に特異的に発現しているのに対し、SERCA2bは全組織に広く存在している。
注2)コンフォメーション
一般に、タンパク質を含む生体高分子鎖は多様な立体構造をとることが可能である。特にタンパク質は、周りの化学的環境や反応中間状態などに応じ、局所的あるいは全体的に立体構造を変化させるが、とり得る各立体構造をコンフォメーションと呼ぶ。
注3)クライオ電子顕微鏡単粒子解析
タンパク質の立体構造を高分解能で決定するための手法の一つ。電子線照射による分子の振動や損傷を抑えるために、観測対象のタンパク質を氷薄膜中に包埋し、マイナス180度の低温に保ったまま電子顕微鏡像を観測する。個々の分子像は、様々な向きで氷薄膜に包埋された分子の投影像であり、数十万から数百万分子の投影像を分類・平均化し、それらを統合して高分解能の三次元構造を構築する。したがって、今回の研究成果のように、一つのタンパク質の一つの状態のデータセットから、複数の異なる構造が同定、決定されることも珍しくない。
注4)アイソフォーム
基本的な機能に関する構造またはアミノ酸配列は同じだが、一部が異なっているタンパク質。異なる遺伝子から発現する。
注5)X線結晶構造解析
分子の構造を高分解能で決定する手法の1つ。分子が規則正しく並んだ結晶に強いX線を照射すると回折が起こり、回折データを解析することで、結晶を構成する分子の構造を原子レベルで決定することができる。
注6)ダリエ病
角質が正常に作られなくなり、かさぶたのついた褐色の丘疹が皮膚にたくさんできる皮膚病の一つ。小胞体へカルシウムイオンを輸送するカルシウムポンプSERCA2bの異常が原因で、常染色体優性の遺伝形式をとる。このSERCA2bがうまく機能しなくなることで細胞内のカルシウム濃度の異常が起こり、細胞間結合と表皮細胞分化に異常をきたすと考えられている。
問い合わせ先
<研究に関すること>
東北大学 多元物質科学研究所[web]
(生命科学研究科、理学研究科化学専攻 兼担)
教授 稲葉 謙次(イナバ ケンジ)
Tel:022-217-5604
E-mail:kenji.inaba.a1[at]tohoku.ac.jp
*[at]を@に置き換えてください
Posted on:2022年12月 7日