お知らせ

- トップ
- お知らせ
STING炎症シグナルの終結分子機構
〜新規細胞内分解システムの発見〜
発表のポイント
● DNAウイルスに感染すると、自然免疫応答経路の1つであるSTING注1経路が活性化し、炎症が誘導されますが、炎症がどのように終結するかはわかっていませんでした。
● 細胞内の分解を担う細胞小器官リソソーム注2が、隔離膜注3を利用せずに、活性化状態にあるSTINGを直接取り込んで分解すること、また、この取り込み・分解機構の破綻が、炎症の持続を引き起こすことが明らかになりました。
● 炎症性疾患・神経変性疾患の発症機序の理解、および治療薬の開発につながる成果であり、医学・薬学分野への展開が期待できます。
概要
自然免疫は、生まれながらにして備わっている異物に対する応答機構です。小胞体に局在するSTINGは、DNAウイルス感染防御に必要なタンパク質です。STINGは、DNAウイルス感染時にゴルジ体へ移動し、自然免疫シグナルを活性化することがわかっていました。しかしながら、活性化したシグナルがどのように終結するのかはわかっていませんでした。東北大学大学院生命科学研究科の朽津芳彦研究員、向井康治朗助教、田口友彦教授の研究グループは、活性化したSTINGがリソソームによって直接取り込まれて分解を受けることでシグナルが終結することを明らかにしました。
本研究は、STINGの分解機構、および新たな細胞内分解システムの存在を明らかにした重要な報告です。
本研究成果は、2023年3月14日付(日本時間)でNature Cell Biology誌(電子版)に掲載されます。
詳細な説明
研究の背景
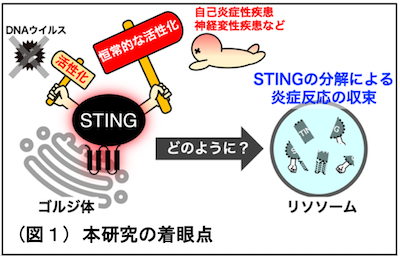 自然免疫応答経路の1つであるSTING経路は、DNAウイルス感染した際に活性化してI型インターフェロンを誘導するシグナル伝達経路です。最近、このSTING経路は ウイルスDNAだけでなく、自己ゲノムDNAやミトコンドリアDNAにも応答すること明らかになり、がん免疫応答において重要な役割を果たすことや、自己炎症性疾患、老化性炎症、パーキンソン病、ハンチントン病、筋萎縮性側索硬化症における炎症病態に寄与することが報告され、非常に注目されています。このようにSTINGの活性化機構の分子メカニズムの解明が進む一方で、STINGシグナルがどのように終結するのかについてはわかっていませんでした。
自然免疫応答経路の1つであるSTING経路は、DNAウイルス感染した際に活性化してI型インターフェロンを誘導するシグナル伝達経路です。最近、このSTING経路は ウイルスDNAだけでなく、自己ゲノムDNAやミトコンドリアDNAにも応答すること明らかになり、がん免疫応答において重要な役割を果たすことや、自己炎症性疾患、老化性炎症、パーキンソン病、ハンチントン病、筋萎縮性側索硬化症における炎症病態に寄与することが報告され、非常に注目されています。このようにSTINGの活性化機構の分子メカニズムの解明が進む一方で、STINGシグナルがどのように終結するのかについてはわかっていませんでした。
今回の取り組み
I)リソソームによるSTINGの内包化・分解現象
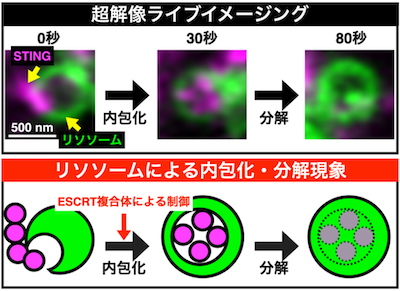 STINGとリソソームを同時に観察できる超高解像ライブイメージング系を実施しました。その結果、STINGはリソソームに接近した後、約30秒でリソソーム内に直接取り込まれ、約80秒で分解されていくことが明らかになりました(図2)。続いて、より高い空間分解能をもつ電子顕微鏡技術による観察が必須と考え、CLEM法 (Correlative Light & Electron Microscopy:光-電子相関顕微鏡法)注4を実施しました。CLEM法による観察の結果、直径100nm以下のSTING小胞が複数まとまってリソソーム内に取り込まれていくことが判明しました。
STINGとリソソームを同時に観察できる超高解像ライブイメージング系を実施しました。その結果、STINGはリソソームに接近した後、約30秒でリソソーム内に直接取り込まれ、約80秒で分解されていくことが明らかになりました(図2)。続いて、より高い空間分解能をもつ電子顕微鏡技術による観察が必須と考え、CLEM法 (Correlative Light & Electron Microscopy:光-電子相関顕微鏡法)注4を実施しました。CLEM法による観察の結果、直径100nm以下のSTING小胞が複数まとまってリソソーム内に取り込まれていくことが判明しました。
II)ESCRT複合体による内包化プロセスの制御
次に、本分解機構を制御する分子メカニズムの解明に挑みました。STINGの分解を指標としたスクリーニングを実施したところ、ESCRT(endosomal sorting complexes required for transport)複合体注5がSTINGの内包化を担っていることが明らかになりました(図2)。さらに、内包化が阻害された状況下では、STING自然免疫シグナルが終結できないことも明らかになりました。
今後の展開
今回、STINGがどのようにリソソームへ運搬されて分解されるのか研究を進め、全く予想外なことに、STINGは、「リソソームが細胞質成分を直接内包化する現象」により分解を受けることを見出しました。リソソームが細胞質成分を分解する過程として、マクロオートファジー(2016年ノーベル生理・医学賞の対象となった物質分解機構)がこれまで知られています。この過程は、分解基質をオートファゴソームによって包み込み、ついでオートファゴソームがリソソームと融合することで分解が完遂されるというものです。今回、オートファゴソームをバイパスする新規細胞質分解経路が真核細胞に備わっていることを明らかにしました。マクロオートファジーと本分解経路がどのように協調して、細胞内分子の代謝を行っているのかを理解することが、今後の重要な課題として浮かび上がってきました。興味深いことにESCRT遺伝子の変異は、種々の炎症性疾患・神経変性疾患の原因となっていることから、STING分解異常による持続した自然免疫・炎症応答がこれらの疾患を引き起こしている可能性があります。炎症性疾患・神経変性疾患の発症機序の理解、および治療薬の開発につながる成果であり、医学・薬学分野への展開が期待できます。
謝辞
本研究は日本学術振興会科学研究費助成事業(JP19H00974 (T.T.), JP20H05307 (K.Mukai), JP20H03202 (K.Mukai), JP17K15445 (K.Mukai) 19J21426, (Y.Kuchitsu))、革新的先端研究開発支援事業 (17939604) (T.T.)、戦略的創造研究推進事業 (JPMJCR21E4) (K.Mukai)、センター・オブ・イノベーション(COI)プログラム(JPM-JCE1303) (K.Mukai)、三菱財団(T.T.)、武田科学振興財団(T.T. and K.Mukai)、細胞科学研究財団 (K.Mukai)、住友財団(K.Mukai)、小柳財団 (K.Mukai)、中冨健康科学振興財団 (K.Mukai)、 SGH 財団 (K.Mukai)、高松宮妃癌研究基金 (K.Mukai)を始め、多数の研究費支援を受けて実施されました。
用語説明
注1. STING
Stimulator of interferon genes の略。小胞体に局在する膜貫通型タンパク質で、細胞質 DNA の出現に反応してゴルジ体へ移動し、自然免疫・炎症応答を活性化する。 2014年にSTINGの変異に起因する常染色体顕性の遺伝性自己炎症性疾患SAVI(STING-associated vasculopathy with onset in infancy )が同定され、種々の炎症性疾患の原因となることが判明し、近年大きな注目を集めている。今回、STING自身が分解されることで、炎症シグナルが終結することが明らかになった。
注2. リソソーム
真核細胞が持つ細胞小器官の一つであり、語源は、"lysis(分解)"+"some(~のまとまり)"に由来する。リソソームは生体膜に包まれた構造体であり、内腔に分解酵素をもつ。これまで、細胞外の物質の分解経路(エンドサイトーシス)や細胞内の物質の分解経路(マクロオートファジー)の最終到達地点として、生体内のリサイクルを担う場として知られていた。今回、リソソーム自身が複数のSTING陽性膜小胞を直接取り込み、分解する能力を有することが判明した。
注3. 隔離膜
真核細胞に保存された生体膜構造の一つであり、栄養飢餓や細菌感染などにより、マクロオートファジーが誘導されると、細胞質に出現する。カップ型の隔離膜が伸長し、二重膜小胞のオートファゴソームが形成される。オートファゴソームはリソソームと膜融合し、オートファゴソーム内の生体物質は分解される。今回、STNGの分解には、隔離膜の形成が不要であることがわかった。
注4. CLEM法
光学顕微鏡による蛍光像と電子顕微鏡像を相関させて画像を重ね合わせることで、生体内の膜構造を観察する手法である。この手法を用いることで、蛍光を付加したタンパク質がどのような生体膜に存在するか、を同定できる。今回、この手法により、ゴルジ体を出たSTINGが直径100nmほどの小胞となること、またその小胞が複数まとまってリソソーム内へと取り込まれて分解されることが明らかになった。
注5. ESCRT複合体
Endosomal sorting complexes required for transportの略。細胞膜タンパク質の分解、細胞質分裂やウイルスの出芽などで機能するタンパク質複合体である。ESCRT 複合体の構成要素の異常は神経変性疾患の原因となる。今回、STING分解やSTINGシグナルの終結のためには、ESCRT複合体の機能が必須であることが明らかになった。
論文情報
タイトル:STING signalling is terminated through ESCRT-dependent microautophagy of vesicles originating from recycling endosomes
著者:Yoshihiko Kuchitsu, Kojiro Mukai, Rei Uematsu, Yuki Takaada, Ayumi Shinojima, Ruri Shindo, Tsumugi Shoji, Shiori Hamano, Emari Ogawa, Ryota Sato, Kensuke Miyake, Akihisa Kato, Yasushi Kawaguchi, Masahiko Nishitani-Isa, Kazushi Izawa, Ryuta Nishikomori, Takahiro Yasumi, Takehiro Suzuki, Naoshi Dohmae, Takefumi Uemura, Glen N. Barber, Hiroyuki Arai, Satoshi Waguri* & Tomohiko Taguchi*
*責任著者:
福島県立医科大学医学部 教授 和栗聡
東北大学大学院生命科学研究科 教授 田口友彦
掲載誌:Nature Cell Biology
DOI:10.1038/s41556-023-01098-9
問い合わせ先
<研究に関すること>
東北大学大学院生命科学研究科、理学部生物学科 兼担[web]
教授 田口友彦(たぐち ともひこ)
TEL: 022-795-6676
E-mail: tom_taguchi[at]tohoku.ac.jp
<報道に関すること>
東北大学大学院生命科学研究科広報室
高橋 さやか(たかはし さやか)
TEL: 022-217-6193
E-mail: lifsci-pr[at]grp.tohoku.ac.jp
*[at]を@に置き換えてください
Posted on:2023年3月14日