お知らせ

- トップ
- お知らせ
エンベロープウイルス粒子を蛍光検出する分子プローブを開発
ウイルス感染力を迅速、簡便に計測する技術を目指して
発表のポイント
● 脂質膜を持つウイルス(エンベロープウイルス)の粒子構造に選択的に結合する蛍光プローブ(注1)を開発しました。
● ウイルス粒子を直接検出することで、ウイルスの感染力を簡便かつ迅速な評価が可能となります。
● ウイルス検体の感染力評価技術として感染症拡大抑制対策にも有用です。
概要
新型コロナウイルスを含めて、ここ10年程の間に世界的に大流行したウイルス感染症のほとんどは、脂質膜を持つウイルス(エンベロープウイルス)によるものです。ウイルスによる感染症拡大抑制対策にはウイルス解析技術が必要不可欠であり、一般にはウイルス粒子内に含まれるタンパク質を計測する抗体法ならびにゲノム(核酸)を計測するPCR法が用いられています。一方、これらはいずれもウイルス粒子構造を破壊後に解析する手法であるため、そのままでは、ウイルス粒子の機能(たとえば感染力など)を評価することは困難です。
今回、東北大学大学院理学研究科の佐藤雄介准教授と西澤精一教授の研究グループは名古屋大学大学院医学系研究科の佐藤好隆准教授、東北大学大学院医工学研究科の永富良一教授らとの共同研究により、エンベロープウイルス粒子の脂質膜に結合し蛍光応答を示す分子プローブ(M2-NR)の開発に成功しました。M2-NRはウイルス粒子構造の特徴である高曲率性脂質膜表面の脂質パッキング欠損(注2)に結合して蛍光応答を示すため、プローブの応答に基づいてウイルス感染力を簡便かつ迅速に評価することができます。M2-NRはヒト風邪コロナウイルス(HCoV-229E)、A型インフルエンザウイルス、単純ヘルペスウイルス、レンチウイルスなど様々な種類のエンベロープウイルス解析・感染力評価に適用できます。
本研究成果は、2025年1月22日(米国東部時間)にアメリカ化学会(ACS)の「Analytical Chemistry」誌に掲載されました。
詳細な説明
研究の背景
ここ10年程の間に局所的・世界的流行を引き起こしたウイルス感染症のほとんどは、脂質膜を持つウイルス(エンベロープウイルス)によるものです。ウイルス解析技術は感染症拡大抑制対策において必要不可欠です。一般にウイルス解析はウイルス粒子に内包されているタンパク質を計測する抗体法やゲノム(核酸)を計測するPCR法が用いられています。これら既存技術はウイルス感染症診断に有用であるものの、いずれもウイルス粒子を破壊後にその成分を計測することに基づいているため、ウイルス粒子としての機能を解析することは容易ではありません。粒子構造を破壊せずに機能解析することができれば、ウイルス粒子の機能、たとえばウイルスの感染力を評価することが可能になると期待できます。
今回の取り組み
本研究では、ヒト風邪コロナウイルス229E(HCoV-229E)をモデルとして、ウイルス粒子構造に結合し蛍光応答を示す分子プローブを開発しました(図1)。これまで研究グループでは高い曲率を有する脂質二重膜の表面に現れる脂質パッキング欠損を認識しうる両親媒性αヘリックスhペプチド(AHペプチド)(注3)をベースとして、細胞外小胞(注4)の検出を指向した蛍光応答性分子プローブの開発を進めてきました(RSC Adv., 2020, 10, 38323.; ACS Sens., 2023, 8, 522.)。本研究では、直径120 nm(ナノメートル)程度のHCoV-229Eウイルス粒子が細胞外小胞同様に高曲率性脂質膜を有していることからその表面には脂質パッキング欠損構造が生じると考え、HCoV-229Eに対して優れた結合能を有するAHペプチドを探索しました。その結果、インフルエンザウイルスのM2タンパク質にあるAHペプチド(M2ペプチド)が有用であることを見いだし、M2ペプチドのN末端に疎水場応答性蛍光色素であるナイルレッド(NR)を連結したプローブM2-NRを設計・合成しました(図2)。M2-NRはウイルス粒子の脂質膜に結合し蛍光応答を示すため、ウイルス由来RNAやタンパク質には応答せず、HCoV-229Eウイルス粒子選択性を持ちます。
M2-NRはHCoV-229Eウイルス粒子に応答するため、ウイルス感染力評価に有用です。一般にウイルス感染力価(Virus Infectivity Titer、以下タイター)(注5)は感染による細胞変性効果(CPE)(注6)を観察することで算出されますが(単位:TCID50/mL)(注7)、操作が煩雑であり解析には通常1週間以上かかります。異なる感染力を持つ5種類のHCoV-229Eサンプルを調製し、M2-NRの蛍光応答に基づく検量線から算出されたタイターは、細胞変性法により決定したタイターと非常に高い相関を示しました(図3)。M2-NRを検出プローブとして用いる本手法は、ウイルス粒子を直接計測することに基づいているため、サンプルと混ぜて蛍光解析するという簡便な操作で迅速に(5分程度)感染力評価が可能です。また、M2-NRはHCoV-229E以外にもA型インフルエンザウイルス、単純ヘルペスウイルスなど様々なエンベロープウイルスの感染力評価にそのまま適用できることを実証しました。またCPEが不明瞭なエンベロープウイルスであるレンチウイルスの感染力評価も可能です。
今後の展開
異なるエンベロープウイルスが混在するサンプルへの適用や感染細胞から放出されうる細胞外小胞の影響など課題はあるものの、本研究で開発したウイルス粒子の脂質膜を標的とした分子プローブは、ウイルス粒子の構造・機能解析など基礎研究に加えて、ウイルス感染症の診断・予防・治療などへの応用が期待されます。今後は開発した技術を応用することで生体試料に含まれるウイルス感染力をその場で簡便かつ迅速に評価し、感染者の隔離期間の決定など感染症対策に有用な分析技術に展開することを目指していきます。
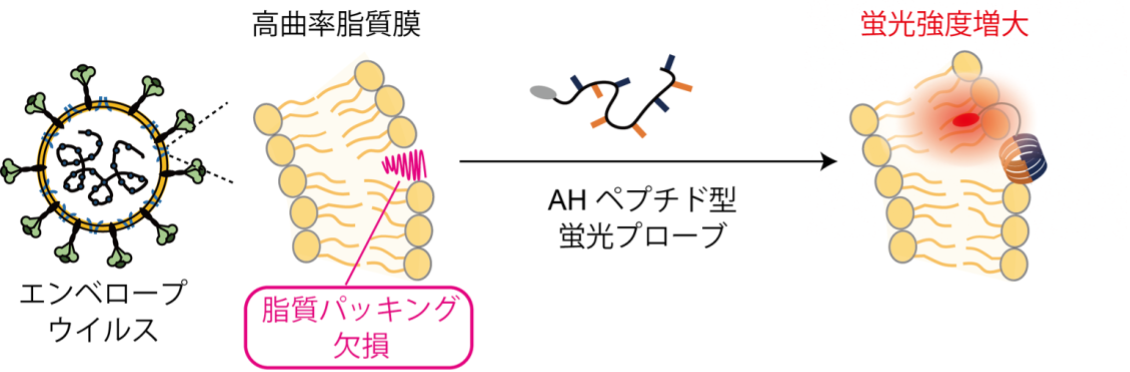
図1. エンベロープウイルスの脂質膜にある脂質パッキング欠損に結合するAHペプチド型蛍光プローブを用いたエンベロープウイルス蛍光検出
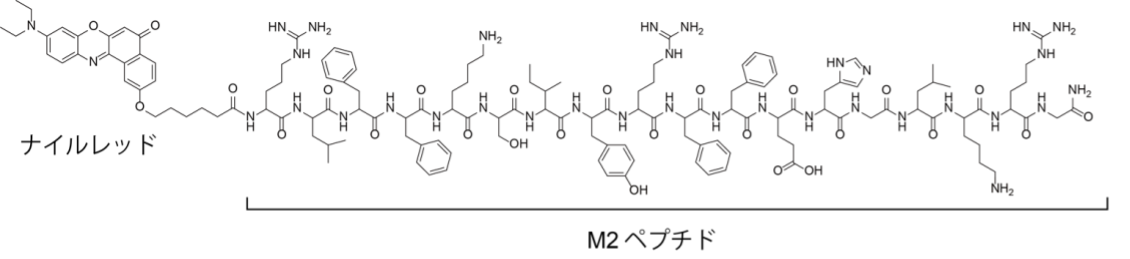
図2. M2-NRの構造式
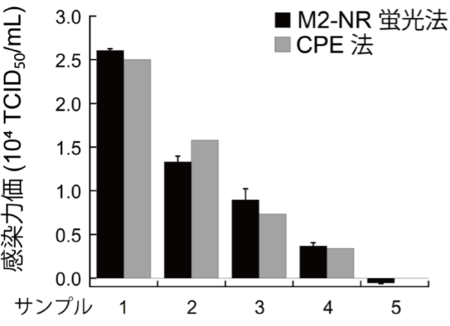
図3. M2-NRの蛍光応答から算出されたHCoV-229EウイルスタイターとCPEに基づき算出されたタイターとの比較
謝辞
本研究は、科学技術振興機構(JST)戦略的創造研究推進事業 さきがけ(JPMJPR19H4、JPMJPR19H5)、同 創発的研究支援事業(JPMJFR236J)、同 戦略的創造研究推進事業CREST(JPMJCR19H4)、JSPS科研費(21K18207, 23H00297)の支援を受けて行われました。本論文は『東北大学2024年度オープンアクセス推進のためのAPC支援事業』によりOpen Accessとなっています(DOI:10.1021/acs.analchem.4c04852)。
用語説明
注1. 蛍光プローブ:特定の分子や構造と反応すると、蛍光の強度や色調が変化する機能性分子の総称。
注2. 脂質パッキング欠損:直径が100 nm程度の脂質小胞において、高い膜曲率のため膜を構成する脂質分子の整列(パッキング)が乱れた局所的な構造。
注3. 両親媒性αヘリックスhペプチド(AHペプチド):α-ヘリックス構造を取った際に、疎水面と親水面が生じるペプチド配列。両親媒性αヘリックスhペプチドの中には、その疎水面が、高い曲率を持つ脂質二重膜の表面に現れる脂質パッキング欠損構造に挿入(疎水性挿入)される性質を持つものがある。
注4. 細胞外小胞:細胞から放出される小胞(例:エクソソーム)。表面は膜タンパク質を含む脂質二重膜構造を取っており、核酸やタンパク質など生理活性物質を内包している。
注5. ウイルス感染力価(Virus Infectivity Titer):試料中に含まれる感染性を持つウイルス量のこと。Titer(タイター)とは特定の物質や成分が含まれる液体の濃度を示す単位。
注6. 細胞変性効果(CPE):ウイルスの侵入・感染により引き起こされる宿主細胞の形態変化。
注7. TCID50/mL:1mL中における50%の培養細胞を死滅させうるウイルス量。
論文情報
タイトル:Viral Membrane-Targeting Amphipathic Helical Peptide-Based Fluorogenic Probes for the Analysis of Infectious Titers of Enveloped Viruses
著者:Yusuke Sato, Yusaku Hatanaka, Yoshitaka Sato, Kota Matsumoto, Shion Osana, Ryoichi Nagatomi, Seiichi Nishizawa
*責任著者:東北大学大学院理学研究科 准教授 佐藤雄介・東北大学大学院理学研究科 教授 西澤精一
掲載誌:Analytical Chemistry
DOI:10.1021/acs.analchem.4c04852
問い合わせ先
<研究に関すること>
東北大学大学院理学研究科化学専攻[web]
准教授 佐藤 雄介(さとう ゆうすけ)
電話:022-795-6551
E-mail:yusuke.sato.a7[at]tohoku.ac.jp
<報道に関すること>
東北大学大学院理学研究科
広報・アウトリーチ支援室
電話: 022-795-6708
E-mail:sci-pr[at]mail.sci.tohoku.ac.jp
*[at]を@に置き換えてください
Posted on:2025年1月24日